题目内容
7.T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:| 元素符号 | 元素性质或原子结构 |
| T | 其一种无色氧化物遇空气变为红棕色 |
| W | 其单质和化合物的焰色反应焰色均呈黄色 |
| X | 基态原子的最外层电子排布式为(n+1)sn(n+1)pn+2 |
| Y | 单质常温下为气体,可用于自来水消毒 |
| Z | 一种核素的质量数为56,中子数为30 |
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
分析 T的某一种无色氧化物遇空气变为红棕色,为NO遇到氧气变成红棕色的二氧化氮,则T为N元素;W的单质和化合物的焰色均呈黄色,则W为Na元素;X的原子的最外层电子排布式为(n+1)sn(n+1)pn+2,n=2,其最外层电子排布为:3s23p4,则X为S元素;Y单质常温下为气体,可用于自来水消毒,则Y为Cl元素;Z的一种核素的质量数为56,中子数为30,Z的质子数=56-30=26,则Z为Fe元素,据此进行解答.
解答 解:T的某一种无色氧化物遇空气变为红棕色,为NO遇到氧气变成红棕色的二氧化氮,则T为N元素;W的单质和化合物的焰色均呈黄色,则W为Na元素;X的原子的最外层电子排布式为(n+1)sn(n+1)pn+2,n=2,其最外层电子排布为:3s23p4,则X为S元素;Y单质常温下为气体,可用于自来水消毒,则Y为Cl元素;Z的一种核素的质量数为56,中子数为30,Z的质子数=56-30=26,则Z为Fe元素,
(1)Z为Fe元素,位于周期表中VIII 族,Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,价层电子排布式为:3d64s2,故答案为:VIII,3d64s2;
(2)T为N元素,则T2H4为N2H4,N原子最外层5个电子,若要满足最外层达到8个电子,每个N原子需要形成3个共价键,其中氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为: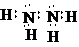
故答案为:4:1;离子;
(3)W、X和Y三种元素分别为Na、S、Cl,同一周期中随着原子序数的递增,第一电离能呈减小趋势,则第一电离能最大的为Na;离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则三种离子大小为:Na+<Cl-<S2-,
故答案为:Na;Na+<Cl-<S2-;
(4)Z为Fe,铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,故答案为:3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查位置、结构与性质关系达到综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| A. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| D. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |
| A. |  点燃酒精灯 | B. |  向容量瓶转移液体 | ||
| C. |  读取液体体积 | D. |  加热液体 |
| A. | 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯 | |
| B. | 棉花、羊毛、蚕丝和麻等是天然纤维 | |
| C. | 高聚物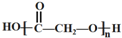 中的官能团是酯基 中的官能团是酯基 | |
| D. | 可以用溴水鉴别乙醛和乙烯 |
| A. | K+、H+、ClO-、I- | B. | Fe3+、Mg2+、NO3-、CO32- | ||
| C. | K+、Ca2+、HCO3-、OH- | D. | Al3+、NH4+、Cl-、SO42- |
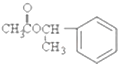
| A. | 该栀子酯的分子式C10H11O2 | |
| B. | 1mol栀子酯水解需要消耗2mol NaOH | |
| C. | 栀子酯可以发生加成、取代和消去反应 | |
| D. | 栀子酯的一氯代物有六种 |
| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |
| A. | 用CoCl2溶液浸泡过的棉花制成简易湿度计,悬挂在家中,以粗略估计空气的湿度 | |
| B. | 在1mL0.5mol/L的AlCl3溶液中加入2mL饱和的NaF溶液,再加入1mL3.mol/L的氨水,整个过程都无明显现象 | |
| C. | 向1mL1%的NaOH溶液中加入2ml2%的CuSO4溶液,振荡后再加入0.5mL有机物X,溶液呈现绛蓝色,则X是甘油 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏高 |