题目内容
17. 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液显中性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
分析 0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,HCl+BOH=BCl+H2O,所得溶液中B+浓度小于0.1mol/L,说明在溶液中存在B++H2O?H++BOH,B0H为弱碱,BCl溶液呈酸性,则c(OH-)<c(H+),一般来说,盐类的水解程度较小,则:c(B+)>c(H+),反应后溶液中离子浓度大小为:c(Cl-)=0.1mol/L>c(B+)>c(H+)>c(BOH)>c(OH-)即X表示H+,Y表示BOH,Z表示OH-,溶液中存在物料守恒为:c(Cl-)=c(B+)+c(BOH),
A.BOH为弱碱,反应后生成强酸弱碱盐,溶液显示酸性;
B.升温促进水解,则c(Y)增大;
C.X表示H+,Y表示BOH,Z表示OH-,溶液中存在物料守恒为:c(Cl-)=c(B+)+c(BOH);
D.稀释溶液促进水解,但是溶液中氢离子浓度减小.
解答 解:0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,HCl+BOH=BCl+H2O,所得溶液中B+浓度小于0.1mol/L,说明在溶液中存在B++H2O?H++BOH,B0H为弱碱,BCl溶液呈酸性,则c(OH-)<c(H+),一般来说,盐类的水解程度较小,则:c(B+)>c(H+),反应后溶液中离子浓度大小为:c(Cl-)=0.1mol/L>c(B+)>c(H+)>c(BOH)>c(OH-)即X表示H+,Y表示BOH,Z表示OH-,溶液中存在物料守恒为:c(Cl-)=c(B+)+c(BOH),
A.BOH为弱碱,反应生成弱酸弱碱盐BCl,则溶液显酸性,故A错误;
B.盐的水解为吸热反应,升温促进水解,则Y浓度增大,故B错误;
C.X表示H+,Y表示BOH,Z表示OH-,溶液中存在物料守恒为:c(Cl-)=c(B+)+c(BOH),故C正确;
D.稀释后促进水解,但是溶液中氢离子浓度减小,即c(X)减小,故D错误;
故选C.
点评 本题考查了酸碱混合溶液定性判断,题目难度中等,根据酸的强弱结合物料守恒、电荷守恒分析解答,涉及离子浓度大小比较、溶液pH值、盐类水解等知识,判断一元碱BOH是弱碱为解题关键.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | 生成的铜的物质的量是0.2mol | B. | 随着电解进行溶液的pH减小 | ||
| C. | 转移电子的物质的量为0.4mol | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
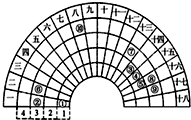 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应的简单离子半径依次增大 | |
| B. | ⑥的氯化物的熔点比⑦的氯化物熔点高 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子 |
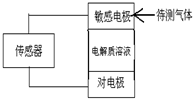 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池正极 | |
| B. | 检测Cl2时,敏感电极上发生还原反应 | |
| C. | 检测H2S时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生电流大小相同 |
| A. | K+、H+、ClO-、I- | B. | Fe3+、Mg2+、NO3-、CO32- | ||
| C. | K+、Ca2+、HCO3-、OH- | D. | Al3+、NH4+、Cl-、SO42- |
| A. | 新制氢氧化铜和乙醛反应的离子方程式:CH3CHO+2Cu(OH)2+OH- $→_{加热}^{水浴}$ CH3COO-+Cu2O↓+3H2O | |
| B. | 苯酚与碳酸钠溶液反应:C6H5OH+CO32-→C6H5O-+HCO3- | |
| C. | 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol | |
| D. | 可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性: 2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 煤的气化、石油分馏、海水制镁、海带提碘等过程中都包含化学变化 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝、羊毛和人造丝的主要成分都是蛋白质 | |
| D. | 甲苯能够被酸性高锰酸钾溶液氧化成苯甲酸,而甲烷不反应,说明苯环能够使甲基变活泼 |
| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 标准状况下,0.1mol氯仿的体积为2.24L | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3SO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA |
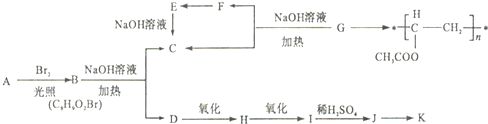
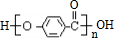
 .
. .
.