题目内容
18.(Ⅰ)无机盐A是医学上常用的镇静催眠药,由两种元素组成.将其溶于水,通入适量黄绿色气体B,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色.分液后取上层溶液,经元素分析,溶质为漂白粉的主要成分之一,往此溶液通入CO2和NH3可获得纳米材料E和铵态氮肥F.(1)无机盐A中阳离子的结构示意图
 .
.(2)工业上制取漂白粉的化学反应方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(3)CO2和NH3两气体中,应该先通入溶液中的是NH3(填化学式),写出制备E和F的离子反应方程式2NH3+CO2+Ca2++H2O=CaCO3+2NH4+.
(Ⅱ)某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908g•mol-1)的组成和性质,设计并完成了如下实验

取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H.
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应. ②常温下B呈液态且1个B分子含有10个电子
请回答如下问题:
(1)写出B分子的电子式
 .
.(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体.请写出该反应的离子方程式为3Cu2O+14H++2NO3-=6Cu2++2NO+7H2O.
(3)X的化学式是Cu4(OH)6SO4,在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为Cu4(OH)6SO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+3H2O.
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O、6CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu2O+3H2O.设计一个实验方案探究红色固体的成分红色固体的成分可能是Cu,或Cu2O,或Cu与Cu2O混合物;准确称取一定量的红色固体,在NH3气流中加热至恒重后,如式样无失重,则为Cu;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为Cu2O,或Cu与Cu2O混合物..
分析 I.无机盐A是由两种元素组成,将其溶于水,通入适量黄绿色气体B,则B为氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色,则A中含有溴元素,分液后取上层溶液,经元素分析,溶质为漂白粉的主要成分之一,则溶液中有钙元素,所以A为溴化钙,往此溶液通入CO2和NH3可获得纳米材料E和铵态氮肥F,则F为NH4Cl,E为CaCO3,
(1)根据上面的分析可知,A为溴化钙,钙离子质子数为20,核外电子数为18;
(2)工业上用氯气与氢氧化钙反应制取漂白粉;
(3)CO2和NH3两气体中,由于氨气极易溶于水,而二氧碳在水中溶解度不大,所以应该先通入溶液中的是 NH3;CO2、NH3、Ca2+和H2O反应生成CaCO3和NH4+.
II.浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,得到A、B和黑色固体C,常温下B呈液态且1个B分子含有10个电子,B为水,A和水反应生成的D能和氯化钡反应生成白色沉淀E,E只能为硫酸钡,23.3g白色沉淀E的物质的量为n=$\frac{m}{M}$=$\frac{23.3g}{233g/mol}$=0.1mol,黑色固体C可能为四氧化三铁、氧化铜、碳等,黑色固体C隔绝空气在1000℃反应生成气体F和红色固体G,G能和硫酸反应生成红色固体和蓝色溶液应为氧化亚铜在酸性溶液中的歧化反应,所以黑色固体G为氧化亚铜,气体F为氧气,红色H为铜,蓝色溶液I为硫酸铜.
(1)水是共价化合物,原子间通过共用电子对形成化学键;
(2)红色固体G为氧化亚铜,溶于稀硝酸,+1价铜被氧化,硝酸被还原;
(3)依据以上分析得n(CuO):n(SO3)=1:4,结合质量守恒分析解答;
(4)黑色固体C为氧化铜,与氨气反应生成氮气(气体丙是大气主要成分之一)、铜或氧化亚铜和水,红色固体可能是Cu,或Cu2O,或Cu与Cu2O混合物,依据Cu与Cu2O的性质设计实验方案.
解答 解:无机盐A是由两种元素组成,将其溶于水,通入适量黄绿色气体B,则B为氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色,则A中含有溴元素,分液后取上层溶液,经元素分析,溶质为漂白粉的主要成分之一,则溶液中有钙元素,所以A为溴化钙,往此溶液通入CO2和NH3可获得纳米材料E和铵态氮肥F,则F为NH4Cl,E为CaCO3,
(1)根据上面的分析可知,A为溴化钙,钙离子质子数为20,核外电子数为18,则钙离子的结构示意图为 ,
,
故答案为: ;
;
(2)工业上制取漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)CO2和NH3两气体中,由于氨气极易溶于水,而二氧碳在水中溶解度不大,所以应该先通入溶液中的是 NH3,这样便于两气体和溶液充分反应,制备E和F的离子反应方程式为Ca2++CO2+2NH3+H2O=CaCO3↓+2NH4+,
故答案为:NH3;Ca2++CO2+2NH3+H2O=CaCO3↓+2NH4+.
II.浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,得到A、B和黑色固体C,常温下B呈液态且1个B分子含有10个电子,B为水,A和水反应生成的D能和氯化钡反应生成白色沉淀E,E只能为硫酸钡,23.3g白色沉淀E的物质的量为n=$\frac{m}{M}$=$\frac{23.3g}{233g/mol}$=0.1mol,黑色固体C可能为四氧化三铁、氧化铜、碳等,黑色固体C隔绝空气在1000℃反应生成气体F和红色固体G,G能和硫酸反应生成红色固体和蓝色溶液应为氧化亚铜在酸性溶液中的歧化反应Cu2O+H2SO4=CuSO4+Cu+H2O,所以黑色固体G为氧化亚铜,气体F为氧气,红色H为铜,蓝色溶液I为硫酸铜,逆推可得:一定量的浅绿色盐X中n(S)=0.1mol,28.8g红色固体G为氧化亚铜,n(Cu2O)=$\frac{28.8g}{144g/mol}$=0.2mol,12.8g红色固体H,n(Cu)=0.2mol,浅绿色盐X中n(Cu)=0.4mol,n(CuO)=0.4mol,浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应,n(S)=0.1mol,n(CuO):n(SO3)=1:4,
浅绿色盐X,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+(m-1)H2O↑,根据氧元素守恒得:m=4,符合M(X)<908g•mol-1,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+3H2O↑,A和B反应SO3+H2O=H2SO4,硫酸与足量氯化钡反应:H2SO4+BaCl2=BaSO4↓+2HCl,白色沉淀E为BaSO4,黑色固体C为氧化铜,在1000℃反应生成气体F为氧气,红色固体G为氧化亚铜4CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑,G氧化亚铜和硫酸发生歧化反应:Cu2O+H2SO4=CuSO4+Cu+H2O,红色H为铜,蓝色溶液I为硫酸铜.
(1)水是共价化合物,氢原子和氧原子之间以共价键结合,其电子式为 ,
,
故答案为: ;
;
(2)红色固体G为氧化亚铜,Cu2O中+1价的铜被硝酸氧化,稀硝酸被还原成一氧化氮,反应为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O,
故答案为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O;
(3)浅绿色盐X中n(Cu)=0.4mol,n(S)=0.1mol,n(CuO):n(SO3)=1:4,仅含四种元素,不含结晶水,设化学式为:Cu4(OH)mSO4,Cu4(OH)mSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+(m-1)H2O↑,根据氧元素守恒得:m=4,则该反应流程为:X在隔绝空气、570℃温度下加热Cu4(OH)6SO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+3H2O,
故答案为:Cu4(OH)6SO4;Cu4(OH)6SO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+SO3↑+3H2O;
(4)空气主要成分为氧气、氮气,黑色固体C为氧化铜,与氨气反应生成氮气、铜(0价)或氧化亚铜(铜为+1价)和水,反应为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O、6CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu2O+3H2O,红色固体的成分可能是Cu,或Cu2O,或Cu与Cu2O混合物,准确称取一定量的红色固体,在NH3气流中加热至恒重后,如式样无失重,则为Cu;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为Cu2O,或Cu与Cu2O混合物,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O、6CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu2O+3H2O;红色固体的成分可能是Cu,或Cu2O,或Cu与Cu2O混合物;准确称取一定量的红色固体,在NH3气流中加热至恒重后,如式样无失重,则为Cu;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为Cu2O,或Cu与Cu2O混合物.
点评 本题考查了物质组成的推断,涉及离子的检验、物质的性质等知识点,熟悉元素化合物的性质、知道流程图中每一步发生的反应及反应现象是解本题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | K+、H+、ClO-、I- | B. | Fe3+、Mg2+、NO3-、CO32- | ||
| C. | K+、Ca2+、HCO3-、OH- | D. | Al3+、NH4+、Cl-、SO42- |
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 在Zn-Cu原电池中加入双氧水后,灯泡亮度增加且持续时间较长 | |
| D. | 海带灼烧成灰烬后,加水煮沸2~3 min并过滤,滤液中可以加入适量的H2O2来氧化I? |
| A. | 用CoCl2溶液浸泡过的棉花制成简易湿度计,悬挂在家中,以粗略估计空气的湿度 | |
| B. | 在1mL0.5mol/L的AlCl3溶液中加入2mL饱和的NaF溶液,再加入1mL3.mol/L的氨水,整个过程都无明显现象 | |
| C. | 向1mL1%的NaOH溶液中加入2ml2%的CuSO4溶液,振荡后再加入0.5mL有机物X,溶液呈现绛蓝色,则X是甘油 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏高 |
| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 标准状况下,0.1mol氯仿的体积为2.24L | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3SO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA |
| A. | 硅石常用作光导纤维、光学仪器的原料 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | 酚醛树脂可作木材粘合剂、制作食用器具 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
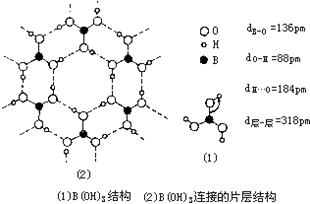 硼及其化合物在现代工业、生活和国防中有重要应用价值.
硼及其化合物在现代工业、生活和国防中有重要应用价值.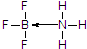 .
.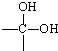 →
→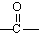 +H2O烃A(分子式为C9H8)有如图的转化关系:
+H2O烃A(分子式为C9H8)有如图的转化关系:
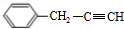 ,指出反应①的反应类型:加成反应.
,指出反应①的反应类型:加成反应. .
.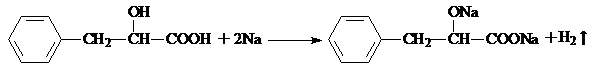 .
.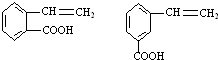 ,请写出其他两种
,请写出其他两种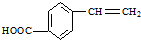 、
、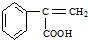 .
.