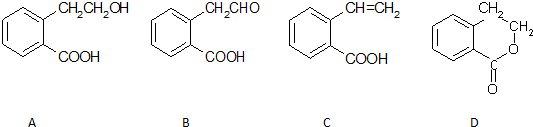
题目内容
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )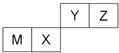
| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
分析 四种短周期元素只有M为金属元素,由元素在周期表中的位置,可知M为Al、X为Si、Y为N、Z为O;
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性越强,最高价氧化物对应水化物的酸性越强;
C.非金属性越强,氢化物越稳定;
D.X为Si,属于原子晶体,熔点最高,常温下Al为固体,在空气中加热时发生熔化,熔点低于晶体硅,而Y的单质为气体.
解答 解:四种短周期元素只有M为金属元素,由元素在周期表中的位置,可知M为Al、X为Si、Y为N、Z为O.
A.N3-、O2-、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:N3->O2->Al3+,故A错误;
B.非金属性N>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:硝酸>硅酸,故B正确;
C.氢化物稳定性与元素非金属性一致,Z的非金属性比X的强,故Z的氢化物更稳定,故C错误;
D.X为Si,属于原子晶体,熔点最高,常温下Al为固体,在空气中加热时发生熔化,熔点低于晶体硅,而Y的单质为气体,Al的熔点高于氮气,故熔点:X>M>Y,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,注意对元素周期律的整体把握,掌握物质熔沸点高低比较.

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
15.化学与人类生活、环境保护及社会可持续发展密切相关,下列有关叙述正确的是( )
| A. | 大量开发利用深海可燃冰,有助于海洋生态环境的治理 | |
| B. | 汽车尾气中含有大量大气污染物,其原因是汽油不完全燃烧造成的 | |
| C. | 煤炭燃烧过程安装固硫装置,目的是提高煤的利用率 | |
| D. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 |
2.将一定质量的镁铜合金加入到100mL某浓度HNO3中,两者恰好反应,假设反应的还原产物只有NO气体.反应后向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀质量比原合金质量增加5.1g;则下列有关叙述中不正确的是( )
| A. | 开始加入合金的总物质的量为0.15mol | |
| B. | 生成NO气体体积在标准状况下为2.24L | |
| C. | 生成沉淀完全时消耗NaOH溶液体积为100mL | |
| D. | 原硝酸物质的量浓度为1mol/L |
12.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
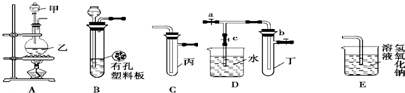
请按要求填空:
(1)利用B装置可制取的气体有H2、CO2(填2种).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由.实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明Cl2的氧化性强于Br2.
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁.试管丁中的NO2与一定量的O2混合后倒插水中,试管$\frac{9}{10}$充满水,则原试管丁中的混合气体的平均分子量可能为42.08或44.04.(保留二位小数)

请按要求填空:
(1)利用B装置可制取的气体有H2、CO2(填2种).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明Cl2的氧化性强于Br2.
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁.试管丁中的NO2与一定量的O2混合后倒插水中,试管$\frac{9}{10}$充满水,则原试管丁中的混合气体的平均分子量可能为42.08或44.04.(保留二位小数)
19.实验测得BeCl2为共价化合物,两个Be-Cl键间的夹角应为( )
| A. | 60° | B. | 90° | C. | 120° | D. | 180° |
16.已知某溶液可能含有NH4+、Na+、Mg2+、Al3+、HCO3-、Cl-、NO2-、SO42-中的几种离子.现取3份,此溶液,分别进行如下实验:
①第1份中滴加盐酸,有气体甲产生;
②第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生;
③第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解.
下列判断正确的是( )
①第1份中滴加盐酸,有气体甲产生;
②第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生;
③第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解.
下列判断正确的是( )
| A. | 气体甲可能为纯净物 | |
| B. | 该溶液中一定存在NH4+、Al3+、NO2-、SO42- | |
| C. | 该溶液中一定不存在Na+、Mg2+、HCO3-、Cl- | |
| D. | 无法确定Na+、HCO3-、NO2-是否存在 |
3.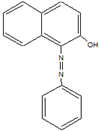 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )| A. | 它属于芳香烃 | B. | 它的分子式为C16H13ON2 | ||
| C. | 它能发生取代反应和加成反应 | D. | 它与苯互为同系物 |
 .
. .
.