题目内容
2.将一定质量的镁铜合金加入到100mL某浓度HNO3中,两者恰好反应,假设反应的还原产物只有NO气体.反应后向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀质量比原合金质量增加5.1g;则下列有关叙述中不正确的是( )| A. | 开始加入合金的总物质的量为0.15mol | |
| B. | 生成NO气体体积在标准状况下为2.24L | |
| C. | 生成沉淀完全时消耗NaOH溶液体积为100mL | |
| D. | 原硝酸物质的量浓度为1mol/L |
分析 将一定量的镁和铜合金加入到HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g.
A.根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根的物质的量,据此计算合金的总物质的量;
B.根据电子转移守恒计算NO物质的量,再根据V=nVm计算NO的体积;
C.加入的氢氧化钠反应生成氢氧化镁、氢氧化铜,根据氢氧根守恒计算NaOH的物质的量,根据V=$\frac{n}{c}$计算加入的氢氧化钠溶液的体积;
D.根据方程式可知参加反应的n反应(HNO3)=4n(NO).再根据c=$\frac{n}{V}$计算.
解答 解:将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为$\frac{0.3mol}{2}$=0.15mol,生成NO为$\frac{0.3mol}{5-2}$=0.1mol,
A.由上述分析可知,镁和铜的总的物质的量为0.15mol,故A正确;
B.标况下NO的体积为0.1mol×22.4L/mol=2.24L,故B正确;
C.加入的氢氧化钠恰好与硝酸镁、硝酸铜反应,由上述分析可知,加入的NaOH为0.3mol,故加入NaO溶液的体积为$\frac{0.3mol}{3mol/L}$=0.1L=100mL,故C正确;
D.根据方程式可知参加反应的n反应(HNO3)=4n(NO)=0.4mol,故原硝酸物质的量浓度为$\frac{0.4mol}{0.1L}$=4mol/L,故D错误,
故选D.
点评 本题考查混合物有关计算,综合考查学生对得失电子守恒等综合运用和解决复杂问题的能力,是一道考查能力的好题,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有金属元素的物质中均存在离子键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
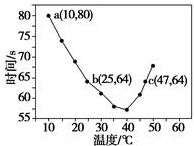
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
| A. | 氧化物 | B. | 单质 | C. | 碱 | D. | 电解质 |
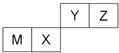
| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |

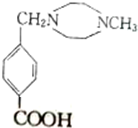 .
.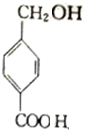 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$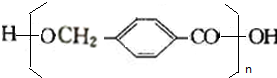 +(n-1)H2O
+(n-1)H2O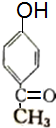 +2Br2→
+2Br2→ +2HBr.
+2HBr.