题目内容
17.有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如下图所示:(1)C的分子式是C9H8O2.
(2)由A生成D的化学方程式是
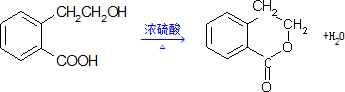 .
.(3)由A生成B的化学方程式是
 .
.(4)关于A、B的描述正确的是abd;
a.都能与新制氢氧化铜悬浊液反应
b.都能与氢气发生加成反应
c.都能发生消去反应
d.都能发生催化氧化反应
分析 A中含有羧基,具有酸性,可发生中和和酯化反应,含有羟基,可发生氧化、消去和取代反应分别生成B、C、D,结合官能团的性质解答该题.
解答 解:(1)由结构简式可知C的分子式C9H8O2,故答案为:C9H8O2;
(2)A→D发生酯化反应,反应条件为浓硫酸并加热,该反应为 ,
,
故答案为: ;
;
(3)由A生成B,-OH转化为-CHO,发生醇的催化氧化反应,该反应为 ,
,
故答案为: ;
;
(4)a.A含有羧基,可与碱发生中和反应,B含有醛基,可与新制氢氧化铜悬浊液发生氧化还原反应,故a正确,
b.都含有苯环,可与氢气发生加成反应,故b正确;
c.B不能发生消去反应,故c错误;
d.A含有醇羟基,B含有醛基,都能发生催化氧化反应,故d正确.
故答案为:abd.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该类题目的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.在加热固体NH4Al(SO4)2•12H2O时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4) 3,下列判断正确的是( )
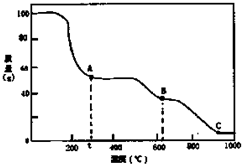

| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |
8.下列4组原子序数的元素,彼此间能形成共价键的是( )
| A. | 8和11 | B. | 8和12 | C. | 15和17 | D. | 12和16 |
12.已知分子式为C12H12的物质A结构简式如图,苯环上的一溴代物有( )
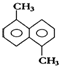

| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
2.下列各组中的反应,属于同一反应类型的是( )
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 | |
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷 | |
| C. | 甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯 | |
| D. | 乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯 |
9.将甲、乙两种金属的性质相比较,
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ①②③④⑤ |
6.下列说法正确的是( )
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )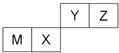

| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |