题目内容
18.Ⅰ.用${\;}_{Z}^{A}$X表示原子:(1)阳离子AXn+中共有x个电子,则该阳离子中含有的中子数目为A-x-n.
(2)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为$\frac{n}{m}$(m-x+2)mol.
Ⅱ.有①${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O ②H2、D2、T2 ③石墨、金刚石 ④${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H四组微粒或物质.回答下列问题:
(1)互为同位素的是①④(填编号).
(2)由①和④中微粒结合形成的水分子种类有18种.
Ⅲ.下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是①④⑤⑦;属于离子化合物,但含有共价键的是③⑧⑨.
分析 Ⅰ.(1)在阳离子中,核电荷数=质子数=核外电子数+所带电荷数,中子数=质量数-质子数,据此分析;
(2)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为m-x+2,计算出n克A2-离子的物质的量,则可计算电子个数;
Ⅱ.(1)具有相同质子数,不同的中子数的核素互称同位素;
(2)氢原子有三种同位素H、D、T,氧原子有三种同位素168O、178O和188O,依此判断水分子的种数;
Ⅲ.一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:Ⅰ.(1)根据在阳离子中:核电荷数=质子数=核外电子数+所带电荷数,即核电荷数=质子数=x+n,又根据中子数=质量数-质子数=A-(x+n),
故答案为:A-x-n;
(2)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为:m-x+2,
n(A2-)=$\frac{n}{m}$mol,则n克A2-离子中包含电子个数是$\frac{n}{m}$molmol×(m-x+2)×NA/mol=$\frac{n}{m}$(m-x+2)mol;
故答案为:$\frac{n}{m}$(m-x+2)mol;
Ⅱ.(1)①${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O的质子数相同,中子数不同,故互为同位素;
②H2、D2、T2 是由氢的同位素原子构成的氢分子,既不是同位素,也不是同素异形体;
③石墨、金刚石都是由碳元素形成的不同单质,互为同素异形体;
④${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H质子数相同,中子数不同,故互为同位素;
故答案为:①④;
(2)氢原子有三种同位素${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H,氧原子有三种同位素${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O,水分子是由2个氢原子和1个氧原子构成的,故水分子有2×3×3=18种,
故答案为:18;
Ⅲ.①N2中只含共价键,属于单质;
④CH4 ⑤CO2 ⑦H2S中只含共价键,属于共价化合物;
③NH4Cl ⑧KOH ⑨Na2O2中含有离子键和共价键,属于离子化合物;
②MgCl2 ⑩K2O中只含离子键,属于离子化合物;
⑥Ne中没有化学键;
故答案为:①④⑤⑦;③⑧⑨.
点评 本题考查了原子符号的含义、同位素、物质和化学键的关系,明确物质中存在的化学键是解本题关键,题目难度不大.

| A. | 8和11 | B. | 8和12 | C. | 15和17 | D. | 12和16 |
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ①②③④⑤ |
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有金属元素的物质中均存在离子键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
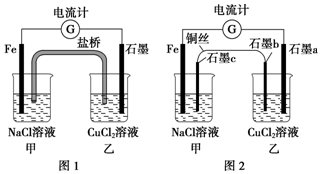 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )| A. | 图2中电流计指针偏转方向与图1中相同 | |
| B. | 图2中石墨a上有铜生成 | |
| C. | 向图2中甲装置石墨c附近滴加酚酞试液,出现红色 | |
| D. | 图2中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe |
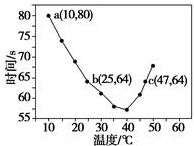
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
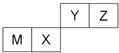
| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |