题目内容
3.在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应.I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |
(1)代表实验①的图示是Ⅳ.
(2)对比实验③和④的目的是探究催化剂对反应速率的影响.
(3)通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快.

Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3mol H2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),测得其中N2物质的量随时间变化如图2所示.回答下列问题:
(4)从开始反应到t2时刻,氨气的平均反应速率为$\frac{1}{2{t}_{2}}$mol/(L•min).
(5)在t3时刻,氢气的转化率为75%.
分析 I.(1)根据温度、浓度、催化剂对反应速率的影响进行判断;
(2)实验③和④反应物的浓度、温度相同,不同条件为是否使用催化剂,据此判断对比实验③和④的目的;
(3)根据表中反应物浓度、反应温度、是否使用催化剂对反应速率的影响得出结论;
Ⅱ.(4)t2时刻氮气的物质的量为0.5mol,根据反应速率的表达式及反应方程式计算出从开始反应到t2时刻氨气的平均反应速率;
(5)根据图象判断在t2时刻氮气的物质的量,再根据反应方程式计算出消耗的氢气的物质的量,最后计算出氢气的转化率.
解答 解:I.(1)温度越高,反应速率越快,使用催化剂,反应速率加快,浓度越大,反应速率越快,实验①中双氧水浓度最小,没有使用催化剂,温度为25℃,则在实验①~④中反应速率最小,甲中斜率越大,反应速率越快,则代表实验①的为Ⅳ,
故答案为:Ⅳ;
(2)根据表中数据可知,实验③④中反应物浓度、反应温度相同,而实验④使用了催化剂,所以对比实验③和④的目的是探究催化剂对反应速率的影响,
故答案为:探究催化剂对反应速率的影响;
(3)根据实验①②可知,增加反应物浓度,反应速率加快;根据实验②③可知,升高反应温度,反应速率加快;根据实验③④可知,使用催化剂,反应速率加快,所以结论为:其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快,
故答案为:其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快;
Ⅱ.(4)根据图象可知,t2时刻氮气的物质的量为0.5mol,氮气的浓度变化为:c(N2)=$\frac{1mol-0.5mol}{2L}$=0.25mol/L,从开始反应到t2时刻,氮气的平均反应速率为:v(N2)=$\frac{0.25mol/L}{{t}_{2}min}$=$\frac{1}{4{t}_{2}}$mol/(L•min),
根据反应N2(g)+3H2(g)?2NH3(g)可知,氨气的平均反应速率为:v(NH3)=2v(N2)=2×$\frac{1}{4{t}_{2}}$mol/(L•min)=$\frac{1}{2{t}_{2}}$mol/(L•min),
故答案为:$\frac{1}{2{t}_{2}}$mol/(L•min);
(5)在t3时刻氮气的物质的量为0.25mol,反应消耗的氮气的物质的量为:1mol-0.25mol=0.75mol,根据反应N2(g)+3H2(g)?2NH3(g)可知,反应消耗的氢气的物质的量为:0.75mol×3=2.25mol,
所以在t3时刻氢气的转化率为:$\frac{2.25mol}{3mol}$×100%=75%,
故答案为:75%.
点评 本题考查影响化学反应速率的因素、化学平衡的计算等知识,题目难度中等,注意掌握化学反应速率、化学平衡的影响因素,明确化学平衡状态的特征,能够根据反应速率表达式及反应速率与化学计量数的关系正确计算出反应速率.

 阅读快车系列答案
阅读快车系列答案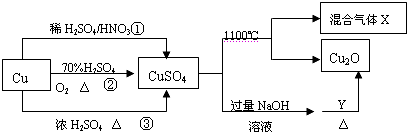
| A. | 1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol(X的组成为SO2、SO3、O2) | |
| B. | 相对于途径①、②,途径③更好地体现了绿色化学理念 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | Y一定是葡萄糖 |
| A. | 石油是混合物,其分馏产品汽油为纯净物 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 金属氧化物均为碱性氧化物 | |
| D. | “血液透析”利用了胶体的性质 |
| A. | Q2<$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2=$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
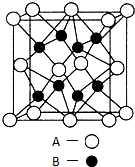 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
 ;
; ;
;
 .
.