题目内容
13.室温时,0.1mol某气态烃与过量的氧气混合,将完全燃烧的产物通过装有足量浓硫酸的洗气瓶,洗气瓶增重9g;将剩余气体再通过氢氧化钠溶液,该瓶增重17.6g.求该气态烃的分子式,并写出它的所有结构简式和名称.分析 浓硫酸吸收水,所以水的质量是9g,n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,根据H原子守恒得n(H)=2n(H2O)=2×0.5mol=1mol,NaOH吸收的气体是CO2,n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,根据C原子守恒得n(C)=n(CO2)=0.4mol,根据有机物中C、H原子守恒知,该分子中C、H原子个数分别是4、10,其分子式为C4H10,据此分析解答.
解答 解:浓硫酸吸收水,所以水的质量是9g,n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,根据H原子守恒得n(H)=2n(H2O)=2×0.5mol=1mol,NaOH吸收的气体是CO2,n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,根据C原子守恒得n(C)=n(CO2)=0.4mol,根据有机物中C、H原子守恒知,该分子中C、H原子个数分别是4、10,其分子式为C4H10,其可能结构简式为CH3CH2CH2CH3,为正丁烷;还可能是(CH3)3CH,为异丁烷,
答:C4H10;CH3CH2CH2CH3、正丁烷;(CH3)3CH、异丁烷.
点评 本题考查有机物分子式及结构简式的确定,明确各物质吸收气体成分是解本题关键,利用原子守恒分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
4.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用溴水或酸性高锰酸钾溶液可以鉴别1-己烯和乙醛 |
1.金融危机之下,中国铝工业受到了巨大的冲击.2009年6月30日至7月2日在上海新国际博览中心举办的中国国际铝工业展览会却提出了“展现铝业盎然生机”的口号,成为全球铝业的焦点和亮点.某化学兴趣小组的同学们决定铝及其化合物的性质比较展开探究活动.搜索到的一些实验数据如下:
铝及其氧化物的有关实验数据如下:
(1)将铝片插入硝酸汞溶液中,铝片表面灰暗,用湿布擦试后,铝片上附着了液态银白色的物质.将该铝片静置一段时间,铝片表面长出白色须状物,手持铝片时,白色须状物脱落,铝片发烫.经实验白色须状物能溶于稀盐酸且无气体放出.试写出直接导致铝片发烫的热化学反应方程式4Al(s)+3O2(g)=2Al2O3(s),△H=-2408KJ/mol.
(2)剪长约6cm、宽2cm的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm).将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调到中间位置.取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL0.5mol/L的硫酸溶液.试回答下列问题:
①两电极同时插入稀硫酸中,电流表指针偏向铝(填“铝”或“铜”)极,铝片上电极反应式为Al-3e-=Al3+;
②两电极同时插入浓硝酸时,电流表指针偏向铜(填“铝”或“铜”)极,此时铝是正(填“正”或“负”)极,铝片上电极反应式为2NO3-+2e-+4H+=2NO2↑+2H2O.
(3)能源问题是人们关心的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想.对此,你的观点是B(填“A”或“B”),其理由是工业上用电解氧化铝的方法制取铝,要消耗大量的电能.A.可行B.不可行.
铝及其氧化物的有关实验数据如下:
| 熔点/℃ | 沸点/℃ | 燃烧热/kJ•mol-1 | |
| 铝 | 660 | 2467 | 602 |
| 氧化铝 | 2050 | 2980 | / |
(2)剪长约6cm、宽2cm的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm).将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调到中间位置.取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL0.5mol/L的硫酸溶液.试回答下列问题:
①两电极同时插入稀硫酸中,电流表指针偏向铝(填“铝”或“铜”)极,铝片上电极反应式为Al-3e-=Al3+;
②两电极同时插入浓硝酸时,电流表指针偏向铜(填“铝”或“铜”)极,此时铝是正(填“正”或“负”)极,铝片上电极反应式为2NO3-+2e-+4H+=2NO2↑+2H2O.
(3)能源问题是人们关心的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想.对此,你的观点是B(填“A”或“B”),其理由是工业上用电解氧化铝的方法制取铝,要消耗大量的电能.A.可行B.不可行.
8.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2.0 g氟化氢所含电子数为0.1NA | |
| B. | 1 mol Na2O2 跟足量H2O反应时得到电子的数目为2NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
18.下列操作不合适的是( )
| A. | 银镜反应采用水浴加热 | |
| B. | 用通过盛溴水的洗气瓶的方法除去甲烷气体中含有的乙烯杂质 | |
| C. | 在乙醛还原新制Cu(OH)2悬浊液的实验中,制Cu(OH)2悬浊液时应保持NaOH过量,可直接加热 | |
| D. | 配制银氨溶液时,将AgNO3溶液滴入氨水中 |
5.某烃C15H24分子结构非常对称,实验证明该烃仅存在三种基团:乙烯基(CH2=CH-)、亚甲基(-CH2-)、次甲基(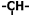 ),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
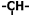 ),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )| A. | 2个,3个 | B. | 5个,3个 | C. | 4个,6个 | D. | 3个,6个 |
3.在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应.
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.
通过实验得到氧气的体积与时间的关系如图1所示,回答下列问题:
(1)代表实验①的图示是Ⅳ.
(2)对比实验③和④的目的是探究催化剂对反应速率的影响.
(3)通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快.

Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3mol H2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),测得其中N2物质的量随时间变化如图2所示.回答下列问题:
(4)从开始反应到t2时刻,氨气的平均反应速率为$\frac{1}{2{t}_{2}}$mol/(L•min).
(5)在t3时刻,氢气的转化率为75%.
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |
(1)代表实验①的图示是Ⅳ.
(2)对比实验③和④的目的是探究催化剂对反应速率的影响.
(3)通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快.

Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3mol H2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),测得其中N2物质的量随时间变化如图2所示.回答下列问题:
(4)从开始反应到t2时刻,氨气的平均反应速率为$\frac{1}{2{t}_{2}}$mol/(L•min).
(5)在t3时刻,氢气的转化率为75%.
 )是一种镇痛和麻醉药物,可由化合物B(
)是一种镇痛和麻醉药物,可由化合物B( )通过以下路线合成得到.
)通过以下路线合成得到.
 .
. +HBr+CH3Br.
+HBr+CH3Br. 等.
等. 所示)的合成路线流程图(无机试剂任选).
所示)的合成路线流程图(无机试剂任选).