题目内容
5.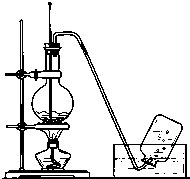 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时:A、酒精与浓硫酸的体积比约为1:3;
B、为避免反应混合液在受热沸腾时剧烈跳动(暴沸),应向混合液中加入适量沸石.
C、加热混合液,使温度迅速升高到170℃就有乙烯生成.
D、实验开始后,烧瓶内的液体颜色很快会由无色变成黑色.原因是浓硫酸将乙烯碳化生成C单质.
分析 A、反应药品浓H2SO4(18.4mol/L)与乙醇按3:1的体积比混合;
B、加热液体时为防止液体暴沸,需要加入碎瓷片;
C、乙醇加热到170摄氏度时发生分子内消去生成乙烯,140摄氏度发生分子间取代反应,据此解答即可;
D、98%的浓硫酸具有强氧化性,能氧化乙醇,据此解答即可.
解答 解:A.所用的反应药品为1体积酒精和3体积浓度为18.4mol/L的硫酸,故答案为:1:3;
B、加热液体时为防止液体暴沸,需要加入碎瓷片或沸石,故答案为:沸石;
C、乙醇加热到170℃时发生分子内消去生成乙烯,故答案为:170;
D、实验中,试管内溶液颜色随反应进行逐渐加深,最后变成黑色,黑色为碳,为98%的浓硫酸具有强氧化性,氧化乙醇所致,故答案为:黑;浓硫酸将乙烯碳化生成C单质.
点评 本题考查了乙烯实验室制备的原理和反应条件分析,题目较简单.注意所用硫酸为浓硫酸,浓硫酸具有强氧化性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.某学生做乙醛的还原性实验时,取1mol/LCuSO4溶液和0.5mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的乙醛,结果无红色沉淀出现.导致该实验失败的原因可能是( )
| A. | 充分加热至沸腾 | B. | 加入乙醛太少 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |
7.已知岩层中的铁橄榄石Fe2SiO4会缓慢转化为磁铁矿:3Fe2SiO4+2CO2→2Fe3O4+3SiO2+2CO,下列说法正确的是( )
| A. | 氧化产物为Fe3O4和SiO2 | |
| B. | 氧化剂与还原剂物质的量的之比为2:3 | |
| C. | 当有1.5mol Fe2SiO4参加反应时,转移的电子为3 mol | |
| D. | 当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol |
13.辉铜矿含铜成分高,是最重要的炼铜矿石,其主要成分为Cu2S,还含有Fe2O3、SO2及一些不溶性杂质.以辉铜矿为原料生产碱式碳酸铜的工艺流程如下: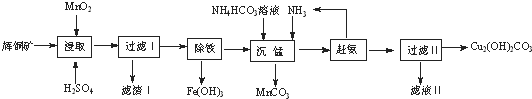
已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生产氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
回答下列问题:
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4,写出浸取时产生CuSO4、MnSO4反应的化学方程式
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;,滤渣Ⅰ的成分为MnSO4、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++CO32-=MnCO3↓.“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度可用滴定法称取6.2500g样品于100mL小烧杯中,加入20mL蒸馏水搅拌,再加入8mL6mol•L-1硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,称取25.00mL配好的溶液于锥形瓶中,加入40.00mL0.2000mol•L-1EDTA溶液,然后计入MnO2,再用0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中Cu2(OH)2CO2的质量分数为78.14%.

已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生产氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4,写出浸取时产生CuSO4、MnSO4反应的化学方程式
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;,滤渣Ⅰ的成分为MnSO4、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++CO32-=MnCO3↓.“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度可用滴定法称取6.2500g样品于100mL小烧杯中,加入20mL蒸馏水搅拌,再加入8mL6mol•L-1硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,称取25.00mL配好的溶液于锥形瓶中,加入40.00mL0.2000mol•L-1EDTA溶液,然后计入MnO2,再用0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中Cu2(OH)2CO2的质量分数为78.14%.
10.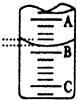 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)在滴定的过程中,时左手轻轻挤压碱式滴定管的玻璃球,右手边滴边振荡锥形瓶,眼睛应观察锥形瓶内溶液颜色变化,至锥形瓶由无色变为浅红色且半分钟内不复原(滴定终点判断),停止滴定,记录滴定管的计数.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol•L-1,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸物质的量浓度的表达式不必化简):$\frac{25.30×c}{V}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)在滴定的过程中,时左手轻轻挤压碱式滴定管的玻璃球,右手边滴边振荡锥形瓶,眼睛应观察锥形瓶内溶液颜色变化,至锥形瓶由无色变为浅红色且半分钟内不复原(滴定终点判断),停止滴定,记录滴定管的计数.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸物质的量浓度的表达式不必化简):$\frac{25.30×c}{V}$.
17.某有机化合物(简称EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
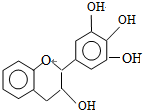

| A. | 分子式为C15H12O5 | |
| B. | 1molEGC与5molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,不能发生消去反应 | |
| D. | 遇FeCl3溶液能发生显色反应 |
14.向一密闭容器中充入1mol N2和3mol H2,在一定条件下反应.下列叙述中,能说明上述反应达到化学平衡状态的是( )
| A. | 容器内混合气体的密度不随时间的变化而变化 | |
| B. | 单位时间内每消耗3mol H2,同时生成2mol NH3 | |
| C. | 混合气体的总质量不随时间的变化而变化 | |
| D. | 混合气体的总物质的量不随时间的变化而变化 |
15.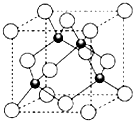 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
