题目内容
4.下列有关除杂的操作中不正确的是( )| A. | FeSO4溶液中含少量CuSO4杂质:加入过量的Fe粉,过滤 | |
| B. | 碳酸钠粉末中含有少量碳酸氢钠粉末:加热 | |
| C. | 除去FeCl3溶液中的FeCl2:加入氯水 | |
| D. | CO2中混有HCl气体:通入饱和的碳酸钠溶液 |
分析 A.Fe与硫酸铜反应生成硫酸亚铁和Cu;
B.碳酸氢钠加热分解生成碳酸钠;
C.氯化亚铁与氯气反应生成氯化铁;
D.二者均与碳酸钠溶液反应.
解答 解:A.Fe与硫酸铜反应生成硫酸亚铁和Cu,则加入过量的Fe粉,过滤可除杂,故A正确;
B.碳酸氢钠加热分解生成碳酸钠,则加热可除杂,故B正确;
C.氯化亚铁与氯气反应生成氯化铁,则加入氯水可除杂,故C正确;
D.二者均与碳酸钠溶液反应,不能除杂,应通入饱和的NaHCO3溶液除去CO2中混有HCl气体,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意除杂的原则,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
14.向一密闭容器中充入1mol N2和3mol H2,在一定条件下反应.下列叙述中,能说明上述反应达到化学平衡状态的是( )
| A. | 容器内混合气体的密度不随时间的变化而变化 | |
| B. | 单位时间内每消耗3mol H2,同时生成2mol NH3 | |
| C. | 混合气体的总质量不随时间的变化而变化 | |
| D. | 混合气体的总物质的量不随时间的变化而变化 |
15.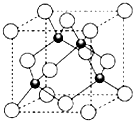 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
12.如图是氢氧燃料电池(电解质为KOH)构造示意图.关于该电池的说法不正确的是( )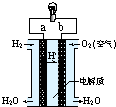

| A. | 电子由b通过灯泡流向a | |
| B. | 氢氧燃料电池是环保电池 | |
| C. | a极是负极 | |
| D. | 正极的电极反应是:O2+2H2O+4e-=4OH- |
19.下列有关乙醇和苯酚的说法中不正确的是( )
| A. | 乙醇和苯酚均无毒,但都能用于消毒、杀菌 | |
| B. | 乙醇和苯酚均能和金属Na反应置换出氢气 | |
| C. | 苯酚能与甲醛反应制造酚醛树脂 | |
| D. | 乙醇的沸点比乙烷高是因为乙醇分子间可以形成氢键 |
9.下列一定能说明HNO2是弱电解质的是( )
①相同条件下,同浓度的HNO2的导电性比盐酸弱 ②用HNO2作导电实验,灯泡很暗
③HNO2能使石蕊试液变红 ④0.1mol/L HNO2溶液的c(H+)=10-2mol/L.
①相同条件下,同浓度的HNO2的导电性比盐酸弱 ②用HNO2作导电实验,灯泡很暗
③HNO2能使石蕊试液变红 ④0.1mol/L HNO2溶液的c(H+)=10-2mol/L.
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ②④ |
14.如图是产生和收集气体的实验装置,该装置适合于( )


| A. | 用浓硝酸与Cu反应制取NO2 | B. | 用浓盐酸和MnO2反应制取Cl2 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用NH4Cl和Ca(OH)2反应制取NH3 |
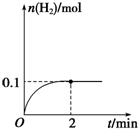 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.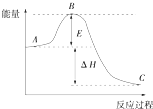 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题: