题目内容
6.室温下下列各组离子或分子在指定的溶液中一定能大量共存的是( )| A. | c(H+)=c(OH-)的溶液中:SO42-、Na+、Cl-、Fe3+ | |
| B. | 在c(HCO3-)=0.1mol•L-1的溶液中:[Al(OH)4]-、Na+、NO3-、C6H5O- | |
| C. | 饱和氯水中:K+、Mg2+、CH3COO-、SO42- | |
| D. | 能使酚酞变红的溶液:Ba2+、NO3-、I-、Na+ |
分析 A.中性溶液中不能大量存在Fe3+;
B.[Al(OH)4]-促进HCO3-的电离;
C.饱和氯水中含氢离子;
D.能使酚酞变红的溶液,显碱性.
解答 解:A.Fe3+在pH为4.4左右沉淀完全,则c(H+)=c(OH-)的中性溶液中不能大量存在Fe3+,故A错误;
B.[Al(OH)4]-促进HCO3-的电离,则不能大量共存,故B错误;
C.饱和氯水中含氢离子,不能大量存在CH3COO-,故C错误;
D.能使酚酞变红的溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、促进电离的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知岩层中的铁橄榄石Fe2SiO4会缓慢转化为磁铁矿:3Fe2SiO4+2CO2→2Fe3O4+3SiO2+2CO,下列说法正确的是( )
| A. | 氧化产物为Fe3O4和SiO2 | |
| B. | 氧化剂与还原剂物质的量的之比为2:3 | |
| C. | 当有1.5mol Fe2SiO4参加反应时,转移的电子为3 mol | |
| D. | 当有1mol CO2参加反应时,被氧化的Fe2SiO4的物质的量为1mol |
17.某有机化合物(简称EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
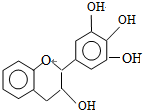

| A. | 分子式为C15H12O5 | |
| B. | 1molEGC与5molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,不能发生消去反应 | |
| D. | 遇FeCl3溶液能发生显色反应 |
14.向一密闭容器中充入1mol N2和3mol H2,在一定条件下反应.下列叙述中,能说明上述反应达到化学平衡状态的是( )
| A. | 容器内混合气体的密度不随时间的变化而变化 | |
| B. | 单位时间内每消耗3mol H2,同时生成2mol NH3 | |
| C. | 混合气体的总质量不随时间的变化而变化 | |
| D. | 混合气体的总物质的量不随时间的变化而变化 |
11.下列离子方程式的书写正确的是( )
| A. | 0.1 mol•L-1的NaHSO3溶液与0.2 mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ | |
| B. | 等浓度的Fe2(SO4)3溶液和Ba(OH)2溶液混合:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓+3BaSO4↓ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | H218O中投入过氧化钠:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
18.C、N、O、Al、Fe、Cu是常见的六种元素.
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
(3)10g铁放在40mL硝酸溶液中,微热,充分反应后收集到1.792L(标准状况)混合
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
(1)Fe位于元素周期表的第四周期第ⅤⅢ族,Cu的基态原子价电子排布式为3d104s1,
Al原子的基态原子核外有13种运动状态不同的电子.
(2)用“>”或“<”填空:
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
气体(NO2、NO),溶液中残留4.4g固体.写出上述反应的总的化学方程式5Fe+14HNO3$\frac{\underline{\;\;△\;\;}}{\;}$5Fe(NO3)2+NO2↑+3NO↑+7H2O.
(4)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ/mol
Al(s)+O2(g)=Al2O3(s)△H=-1675.7kJ/mol
Al的单质和FeO反应的热化学方程式是2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1.
15. X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
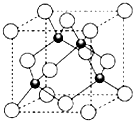
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
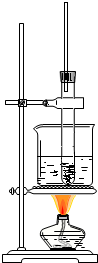 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下: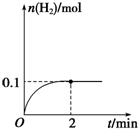 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.