题目内容
20.下列化合物中既有离子键又有共价键的是( )| A. | KBr | B. | NaOH | C. | HBr | D. | MgCl2 |
分析 一般活泼金属元素与活泼非金属元素易形成离子键,非金属元素与非金属元素之间易形成共价键,以此解答该题.
解答 解:A.KBr为离子化合物,只含有离子键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,故B正确;
C.HBr为共价化合物,只含有共价键,故C错误;
D.MgCl2为离子化合物,只含有离子键,故D错误.
故选B.
点评 本题考查了化学键的判断,为高频考点,根据物质的构成微粒及微粒间的作用力来分析解答,注意离子键和共价键的区别,题目难度不大.

练习册系列答案
相关题目
10. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
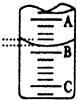
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)在滴定的过程中,时左手轻轻挤压碱式滴定管的玻璃球,右手边滴边振荡锥形瓶,眼睛应观察锥形瓶内溶液颜色变化,至锥形瓶由无色变为浅红色且半分钟内不复原(滴定终点判断),停止滴定,记录滴定管的计数.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol•L-1,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸物质的量浓度的表达式不必化简):$\frac{25.30×c}{V}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)在滴定的过程中,时左手轻轻挤压碱式滴定管的玻璃球,右手边滴边振荡锥形瓶,眼睛应观察锥形瓶内溶液颜色变化,至锥形瓶由无色变为浅红色且半分钟内不复原(滴定终点判断),停止滴定,记录滴定管的计数.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸物质的量浓度的表达式不必化简):$\frac{25.30×c}{V}$.
11.下列离子方程式的书写正确的是( )
| A. | 0.1 mol•L-1的NaHSO3溶液与0.2 mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ | |
| B. | 等浓度的Fe2(SO4)3溶液和Ba(OH)2溶液混合:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓+3BaSO4↓ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | H218O中投入过氧化钠:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
8.下列物质中同时具有离子键、共价键和配位键的是( )
| A. | H3O+ | B. | NaOH | C. | NH4Cl | D. | H2SO4 |
15. X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
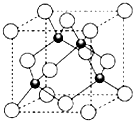
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
5.定容容器中反应:N2(g)+3H2(g)?2NH3(g),下列措施不能提高其反应速率的是( )
| A. | 升高温度 | B. | 使用催化剂 | ||
| C. | 充入稀有气体,增大体系压强 | D. | 增加N2和H2的起始量 |
12.如图是氢氧燃料电池(电解质为KOH)构造示意图.关于该电池的说法不正确的是( )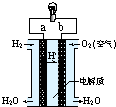

| A. | 电子由b通过灯泡流向a | |
| B. | 氢氧燃料电池是环保电池 | |
| C. | a极是负极 | |
| D. | 正极的电极反应是:O2+2H2O+4e-=4OH- |
9.下列一定能说明HNO2是弱电解质的是( )
①相同条件下,同浓度的HNO2的导电性比盐酸弱 ②用HNO2作导电实验,灯泡很暗
③HNO2能使石蕊试液变红 ④0.1mol/L HNO2溶液的c(H+)=10-2mol/L.
①相同条件下,同浓度的HNO2的导电性比盐酸弱 ②用HNO2作导电实验,灯泡很暗
③HNO2能使石蕊试液变红 ④0.1mol/L HNO2溶液的c(H+)=10-2mol/L.
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ②④ |
10.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA | |
| B. | 0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA | |
| C. | 46g NO2和N2O4的混合气体中含N原子总数为NA | |
| D. | 等物质的量的NH4+和OH-含电子数均为10NA |