题目内容
10.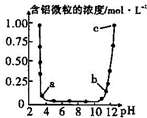 维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )| A. | a点表示溶液中的Al3+开始转化为Al(OH)3沉淀 | |
| B. | 据图可知,配制一定物质的量浓度的AlCl3溶液时,需要加入适量的H2SO4溶液抑制水解 | |
| C. | 当溶液的pH在6至8之间,铝元素全部以Al(OH)3的形式存在 | |
| D. | b点所对应的溶液中主要含铝微粒的水解程度大于c点 |
分析 某AlCl3溶液中加入NaOH固体,首先发生3NaOH+AlCl3=3NaCl+Al(OH)3↓,溶液中Al3+浓度逐渐降低,pH>10时发生NaOH+Al(OH)3=NaAlO2+2H2O,溶液中存在AlO2-,含铝微粒的物质的量浓度逐渐增大,且由图象可知当pH接近4时接近完全生成Al(OH)3,以此解答该题.
解答 解:A.a点表示溶液中的Al3+快要沉淀完全,故A错误;
B.配制一定物质的量浓度的AlCl3溶液时,应该加入盐酸抑制水解,加入硫酸引入新杂质,故B错误;
C.溶液的pH在6至8之间,铝元素不是全部以Al(OH)3的形式存在,纵坐标的值并不为0,故C错误;
D.b、c两点溶液中的主要含有铝微粒为AlO2-,其它条件相同时,浓度越小水解程度越大,故D正确.
故选D.
点评 本题考查含铝化合物的性质,为高频考点,侧重于学生的分析能力的考查,注意把握氯化铝、氢氧化铝的性质,答题时注意正确分析图象,难度中等.

练习册系列答案
相关题目
5.硼烷氨的化学式为H6NB,它是乙烷的等电子体,结构与乙烷类似.硼烷氨是最基本的硼氨化合物,因为氢经济的发展,硼烷氨因其稳定的储氢能力引起人们关注.下列有关硼烷氨的说法中正确的是( )
| A. | 原子半径:B<N | |
| B. | 硼烷氨分子与乙烷分子结构相似,分子内既含有极性共价键又含有非极性共价键 | |
| C. | 硼烷氨分子中的每个原子均达到最外层8电子稳定结构 | |
| D. | 硼烷氨分子中所有的H原子不可能在同一个平面内 |
15.体积、物质的量的浓度均相等的NaCl和NaF两份溶液中阴离子总数关系正确的是( )
| A. | 前者多 | B. | 相等 | C. | 后者多 | D. | 无法判断 |
2.在实验室中,下列除去杂质的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取溴 | |
| B. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入NaOH溶液中振荡,静置,分液 | |
| C. | 乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷 | |
| D. | 乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气 |
5.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )
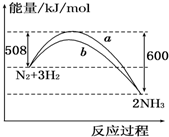

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
 X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: .
.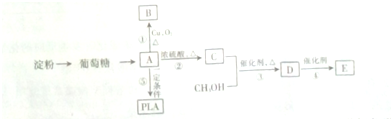
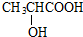 C中所含官能团的名称是羧基、碳碳双键
C中所含官能团的名称是羧基、碳碳双键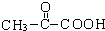 +2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$
+2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$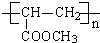
 +(n-1)H2O
+(n-1)H2O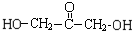 、
、 .
. 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.