题目内容
1.正确的打“√”,错误的打“×”.(1)过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液.洛液呈红色,稀硝酸将铁氧化为Fe3+ ( )
(2)用玻璃棒蘸取浓氨水点到红色石蕊试纸上.试纸变蓝色,故浓氨水呈碱性( )
(3)向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体.HNO3分解生成NO2( )
(4)CO、NO、NO2都是大气污染气体.在空气中都能稳定存在( )
(5)将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu( )
(6)铁溶于稀硝酸,溶液变黄,是因为发生反应:3Fe+8H++2NO3═3Fe2++2NO↑十4H2O( )
(7)焊接金属、灯泡填充、贮存粮食、罐头、水果等,常用氮气作保护气以防止氧化或腐烂( )
(8)NH3 经催化氧化生成N0属于氮的固定( )
(9)氮的氧化物是造成光化学烟雾的主要原因,汽车尾气大量排放会造成光化学烟雾( )
(10)王水是浓硝酸与浓盐酸按照体积比1:3混合而成( )
(11)所有铵盐与NaOH溶液的反应都可表示为:NH4++OH-=NH3↑+H2O (
(12)氨水直接作为氮肥比铵盐作为氮肥效果好( )
分析 (1)过量的Fe粉中加入稀HNO3,反应生成二价铁离子,二价铁离子遇到KSCN溶液不变色;
(2)浓氨水电离生成氢氧根离子,溶液显碱性;
(3)NO3-在酸性条件下具有氧化性,被还原生成NO,NO被O2氧化为红棕色的NO2;
(4)一氧化氮与空气中的氧气反应生成二氧化氮;
(5)NH3通入热的CuSO4溶液反应生成氢氧化铜沉淀;
(6)三价铁离子为黄色;
(7)氮气化学性质稳定,一般条件下不会参与化学反应;
(8)氮的固定指的是游离态氮转化为化合态;
(9)光化学烟雾是大气中的氮氧化物与碳氢化合物经过紫外线照射发生反应形成了光化学烟雾;
(10)王水是浓硝酸与浓盐酸按照体积比3:1混合而成;
(11)少量NH4HCO3与过量NaOH反应生成碳酸钠、氨气、水,其离子反应为NH4++2OH-+HCO3-═NH3↑+H2O+CO32-;
(12)氨水不稳定受热易分解.
解答 解:(1)过量的Fe粉中加入稀HNO3,充分反应后,生成的是二价铁离子,遇到遇到KSCN溶液不变色不显红色,故错误;
(2)浓氨水电离生成氢氧根离子,溶液显碱性,则用玻璃棒蘸取浓氨水点到红色石蕊试纸上、试纸变蓝色,故正确;
(3)向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故错误;
(4)一氧化氮与空气中的氧气反应生成二氧化氮,空气中不能稳定存在,故错误;
(5)NH3通入热的CuSO4溶液反应生成氢氧化铜沉淀,不会生成铜,故错误;
(6)铁溶于稀硝酸,溶液变黄,是因为发生反应生成硝酸铁,硝酸铁显黄色,故错误;
(7)氮气化学性质稳定,常用氮气作保护气以防止氧化或腐烂,还可以焊接金属、灯泡填充、贮存粮食、罐头、水果等,故正确;
(8)NH3 经催化氧化生成N0,属于化合态之间的转化,故错误;
(9)光化学烟雾由碳氢化合物和氮氧化合物在阳光的作用下起化学反应所产生,故正确;
(10)王水是浓硝酸与浓盐酸按照体积比3:1混合而成,故错误;
(11)碳酸氢铵与NaOH溶液的反应离子方程式NH4++2OH-+HCO3-═NH3↑+H2O+CO32-,故错误;
(12)氨水不稳定受热易分解,氨气逸出,降低肥效,直接作为氮肥比铵盐作为氮肥效果差,故错误;
故答案为:1.×2.√3.×4.×5.×6.×7.√8.×9.√10.√11.×12.×.
点评 本题为综合题,考查了元素化合物知识,侧重考查学生的基础知识的掌握,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA | |
| B. | 常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.01NA | |
| C. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA | |
| D. | 7.8 g Na2O2中含有的阴离子数为0.2NA |
| A. | 反应物的转化率 | B. | 反应体系的压强 | ||
| C. | 正、逆反应的速率 | D. | 反应混合物的浓度 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| C. | 由X、Y、Z、M四种元素共同形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 含有跟链烃基相连的羟基的有机物一定是醇类 | |
| C. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 分子内有苯环和羟基的化合物一定是酚类 |
| 选项 | 叙述 | 结论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性,比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与Na反应生成H2 | 可通过加钠凝聚是否具有气泡产生的方法鉴别乙醇的水溶液和乙酸的水溶液 |
| D | 溶解度小的沉淀易向更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Li | B. | S | C. | Li2S | D. | Li和S |
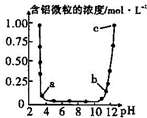 维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )| A. | a点表示溶液中的Al3+开始转化为Al(OH)3沉淀 | |
| B. | 据图可知,配制一定物质的量浓度的AlCl3溶液时,需要加入适量的H2SO4溶液抑制水解 | |
| C. | 当溶液的pH在6至8之间,铝元素全部以Al(OH)3的形式存在 | |
| D. | b点所对应的溶液中主要含铝微粒的水解程度大于c点 |
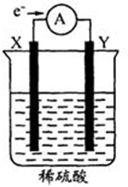 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A. | 外电路的电流方向为:X→导线→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X>Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 溶液中的SO42-向Y极移动 |