题目内容
5.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )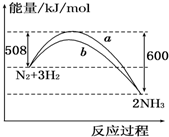
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
分析 A、依据热化学方程式的书写原则,标注物质的聚集状态和反应的热效应,结合断键吸收热量,形成化学键放出热量计算反应的焓变,△H=放出的能量-吸收的能量分析;
B、根据催化剂是降低反应的活化能,加快反应速率,不改变平衡分析;
C、根据催化剂不改变化学平衡,催化剂与能耗的关系分析
D、根据可逆反应的特征:反应物不可能充分进行彻底来回答;
解答 解:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g),△H=-92kJ•mol-1,故A错误;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故C错误;
D、向密闭容器中通入1mol N2和3mol H2,不可能完全转化,所以达到平衡时放出热量Q1kJ<92kJ;另一容积相同的密闭容器中通入2mol N2和6mol H2,达到平衡时放出热量理论上讲应该是2×92kJ=184KJ,但反应物不可能充分进行彻底,所以Q2<184KJ,同时通入2mol N2和6mol H2的压强比通入1mol N2和3mol H2的大了,平衡还会向正向移动,放出的热量还会增大,即Q2>2Q1,故D正确.
故选D.
点评 本题考查了化学反应中能量转化与催化剂的关系,热化学方程式的书写,图象的应用能力,难度不大,注意化学平衡的特征是可逆反应.

练习册系列答案
相关题目
10.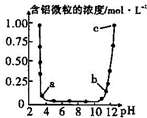 维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
 维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )| A. | a点表示溶液中的Al3+开始转化为Al(OH)3沉淀 | |
| B. | 据图可知,配制一定物质的量浓度的AlCl3溶液时,需要加入适量的H2SO4溶液抑制水解 | |
| C. | 当溶液的pH在6至8之间,铝元素全部以Al(OH)3的形式存在 | |
| D. | b点所对应的溶液中主要含铝微粒的水解程度大于c点 |
16.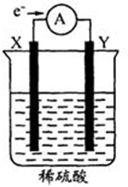 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A. | 外电路的电流方向为:X→导线→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X>Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 溶液中的SO42-向Y极移动 |
13.同周期的X、Y、Z三种主族元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
20.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 单质的还原性 A>B>D>C |
17.下列物质中,在一定条件下既能进行加成反应,也能进行取代反应,并且不能使KMnO4酸性溶液褪色的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙醇 | D. | 苯 |
14.取不同质量的某种镁粉和铜粉的均匀混合物分别与相同浓度的盐酸充分反应,实验数据记录如表:
则该盐酸的物质的量浓度为(mol•L-1)( )
| 实验序号 | (1) | (2) | (3) |
| 取用盐酸的体积/mL | 25 | 25 | 25 |
| 取用混合物的质量/g | 1.32 | 1.54 | 2.20 |
| 生成气体的体积(标准状况)/mL | 336 | 392 | 448 |
| A. | 1.2 | B. | 1.4 | C. | 1.6 | D. | 无法计算 |
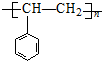
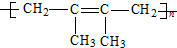
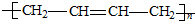
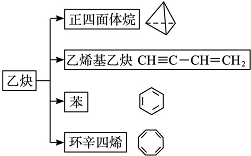
 .
.