题目内容
4. 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.(1)将1.8g木炭置于2.24L(标准状况)氧气中充分燃烧,至反应物耗尽,测得放出热量30.65kJ,则反应过程中共转移电子0.4mol.已知:C(s)+O2(g)=CO2(g)△H=-392.0kJ.mol-1综合上述信息,请写出CO完全燃烧的热化学方程式2CO(g)+O2(g)=2CO2(g)△H=-563KJ/mol.
(2)CO可以合成工业用洁净燃料甲醇,反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.T0℃时,向容积均为50mL密闭容器甲、乙中分别加入1mol CO和2mol H2,发生上述反应,其中乙为绝热容器,反应过程中测得甲容器内压强随时间变化曲线如图所示:
①下列描述中能说明甲容器中的反应达平衡状态的是bd(填序号).
a.2v正(H2)═v逆(CH3OH)
b.CO与CH3OH的体积比不再改变
c.化学平衡常数K的值不再变化
d.CO、H2、CH3OH的浓度均不再变化
②0~8分钟内,甲中v(H2)=2.5mol•L-1•min-1;达到平衡后,甲中CO的转化率大于(填写“大于”、“小于”或“等于”)乙中CO的转化率.
分析 (1)n(C)=$\frac{1.8g}{12g/mol}$=0.15mol,n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应C+O2=CO2,2C+O2=2CO定量关系分析判断反应生成的产物,n(C):n(O2)=0.15:0.1=3:2,所以生成气体为CO和CO2的混合气体,碳和氧气全部反应,电子转移可以依据反应的氧气计算得到,利用直平法写出反应的热化学方程式为:1.8g木炭置于2.24L(标准状况)氧气中充分燃烧,至反应物耗尽,测得放出热量30.65kJ,3molC全部反应放热30.65KJ/mol×20=613KJ/mol;
3C(s)+2O2(g)=2CO(g)+CO2(g)△H=-30.65KJ/mol×20=613KJ/mol,
根据C(s)+O2(g)=CO2(g)△H=-392.0kJ.mol-1,结合盖斯定律计算得到CO完全燃烧生成二氧化碳的热化学方程式;
(2)①化学平衡的标志是正逆反应速率相同个组分含量保持不变,原则是“变量不变”分析选项;
②反应速率V=$\frac{△c}{△t}$计算得到,依据乙为绝热容器,反应是放热反应,温度升高平衡逆向进行分析;甲中气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算反应速率,图象分析可知0~8分钟内,气体压强之比等于气体物质的量之比,则平衡后气体物质的量,$\frac{12.3}{8.2}$=$\frac{3}{n}$,n=2mol
设反应一氧化碳物质的量为x
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
1-x+2-2x+x=2
x=0.5mol.
解答 解:(1)n(C)=$\frac{1.8g}{12g/mol}$=0.15mol,n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应C+O2=CO2,2C+O2=2CO定量关系分析判断反应生成的产物,n(C):n(O2)=0.15:0.1=3:2,所以生成气体为CO和CO2的混合气体,碳和氧气全部反应,电子转移可以依据反应的氧气计算得到电子转移=0.1mol×4=0.4mol,1.8g木炭置于2.24L(标准状况)氧气中充分燃烧,至反应物耗尽,测得放出热量30.65kJ,3molC全部反应放热30.65KJ/mol×20=613KJ/mol;
反应的热化学方程式为:
①3C(s)+2O2(g)=2CO(g)+CO2(g)△H=-613KJ/mol
②C(s)+O2(g)=CO2(g)△H=-392.0kJ.mol-1,
结合盖斯定律计算,②×3-①得到CO完全燃烧生成二氧化碳的热化学方程式;
2CO(g)+O2(g)=2CO2(g)△H=-563KJ/mol;
故答案为:0.4,2CO(g)+O2(g)=2CO2(g)△H=-563KJ/mol;
(2)①化学平衡的标志是正逆反应速率相同个组分含量保持不变,原则是变量不变分析选项;CO(g)+2H2(g)?CH3OH(g)△H<0,反应是气体体积减小放热放热反应;
a.当v正(H2)=2v逆(CH3OH)时,说明甲醇的正逆反应速率相同,反应达到平衡状态,2v正(H2)=v逆(CH3OH),不能说明反应达到平衡状态,故a错误;
b.CO与CH3OH的体积比不再改变,说明物质的量之比不变,能说明反应达到平衡状态,故b正确;
c.化学平衡常数K的值不再变化,不能说明反应达到平衡状态,故c错误;
d.CO、H2、CH3OH的浓度均不再变化是平衡的标志,故d正确.
故答案为:bd;
②反应速率V=$\frac{△c}{△t}$计算得到,图象分析可知0~8分钟内,气体压强之比等于气体物质的量之比,则平衡后气体物质的量,$\frac{12.3}{8.2}$=$\frac{3}{n}$,n=2mol
设反应一氧化碳物质的量为x
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
1-x+2-2x+x=2
x=0.5mol
甲中的v(H2)=$\frac{\frac{0.5mol×2}{0.05L}}{8min}$=2.5mol/L•min,依据乙为绝热容器,反应是放热反应,温度升高平衡逆向进行,所以甲中一氧化碳转化率大于乙中一氧化碳转化率,
故答案为:2.5;大于.
点评 本题考查了化学平衡的计算分析,平衡影响因素分析判断,注意容器特征和平衡移动原理的理解应用,掌握基础是关键,题目难度中等.

| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| C. | 由X、Y、Z、M四种元素共同形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
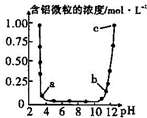 维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )| A. | a点表示溶液中的Al3+开始转化为Al(OH)3沉淀 | |
| B. | 据图可知,配制一定物质的量浓度的AlCl3溶液时,需要加入适量的H2SO4溶液抑制水解 | |
| C. | 当溶液的pH在6至8之间,铝元素全部以Al(OH)3的形式存在 | |
| D. | b点所对应的溶液中主要含铝微粒的水解程度大于c点 |
| 选项 | 现象或事实 | 解释 |
| A | 热的纯碱溶液去油污效果 更好 | 温度升高,增大了油脂在碳 酸钠溶液中的溶解度 |
| B | 生活中的铝制品经久耐用 | 常温时铝不与氧气反应 |
| C | 氢氧化铁胶体通直流电,阴极颜色变深 | 氛氧化铁胶体带正电荷,在电场力的作用下,胶体向阴极迁移 |
| D | 二氧化破用作通讯光缆 | 二氧化硅对光信号有良好的 传输性能 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 铝热反应 |
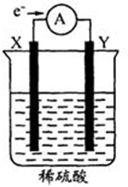 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A. | 外电路的电流方向为:X→导线→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X>Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 溶液中的SO42-向Y极移动 |
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
| 实验序号 | (1) | (2) | (3) |
| 取用盐酸的体积/mL | 25 | 25 | 25 |
| 取用混合物的质量/g | 1.32 | 1.54 | 2.20 |
| 生成气体的体积(标准状况)/mL | 336 | 392 | 448 |
| A. | 1.2 | B. | 1.4 | C. | 1.6 | D. | 无法计算 |