题目内容
20. X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:(1)上述五种元素中电负性最大的是O(填元素符号,下同),Y的第一电离能大于Z的第一电离能原因N原子3p轨道半充满,相对稳定.
(2)XW2的电子式为
 .
.(3)Q的价电子排布式为3d54s2,N3-的分子构型为直线.
(4)下列关于WZ2结构的说法正确的是d.
a.WZ2直线形非极性分子
c.WZ2中w为sp3杂化
b.WZ2直线形极性分子
d.WZ2中W为sp2杂化
(5)α-QW的晶胞是立方体,用X射线衍射法测得该晶体晶胞边长a=520.0pm,26℃测得该晶体的密度为4.1/cm3,请列式计算一个晶胞重含有的Q、W离子数(5.23=140.6)
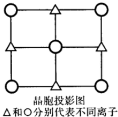
(6)α-QW的晶胞一个侧面的投影图如图所示,与Q离子距离最经且距离相等的W离子构成的几何图形是正八面体.
分析 元素W的原子序数等于元素Z的原子序数加8,说明二者同主族;XW2分子与Y3-为等电子体,即价电子数相同,由于W与Z同主族,且Z原子序数小于W,故可推断出X、Y、Z为相邻元素,分别为C元素、N元素和O元素,W为S元素;N和S2-最外层电子数之和为13,Q的最外层电子数为2,Q原子序数为25,为Mn元素,
(1)元素周期表中,同主族元素从上到下元素的电负性逐渐减小,同周期从左到右,电负性逐渐增大,N元素的第一电离能较大,与核外电子排布有关;
(2)XW2为二氧化碳,为共价化合物;
(3)Q原子序数为25,为Cr元素,结合等电子体判断;
(4)WZ2结构为SO2,为极性分子,中心原子形成2个σ键,孤电子对数为$\frac{6-2×2}{2}$=1;
(5)计算晶胞的质量,可确定离子数;
(6)S2-位于面心,则Mn2+位于棱心,可形成正八面体.
解答 解:元素W的原子序数等于元素Z的原子序数加8,说明二者同主族;XW2分子与Y3-为等电子体,即价电子数相同,由于W与Z同主族,且Z原子序数小于W,故可推断出X、Y、Z为相邻元素,分别为C元素、N元素和O元素,W为S元素;N和S2-最外层电子数之和为13,Q的最外层电子数为2,Q原子序数为25,为Mn元素,
(1)电负性同一周期,从左到右逐渐增大,所以O>N>C,O、S位于同主族,电负性O>S,则最大的为O,由于N原子3p轨道半充满,相对稳定,则第一电离能大于O的第一电离能,故答案为:O;N原子3p轨道半充满,相对稳定;
(2)CS2为直线型,符合8电子稳定结构,电子式写为: ,故答案为:
,故答案为: ;
;
(3)Mn原子序数为25,内层电子排布式与Ar相同,外层电子排布式为:3d54s2,CS2分子与N3-为等电子体,其空间构型和化学键类型相同,空间构型为直线型,
故答案为:3d54s2;直线;
(4)WZ2结构为SO2,为极性分子,中心原子形成2个σ键,孤电子对数为$\frac{6-2×2}{2}$=1,为V形的极性分子,为sp2杂化,故答案为:d;
(5)1mol晶胞的质量为:ρ•V•NA=4.1×6.02×1023×(520×10-10)3=348,设晶胞中含有a个锰离子,含有b个硫离子,则有:55a+32b=347,由于a、b均为正整数,当a=b=4时,等式成立,答:晶胞中含有4个Mn2+和4个S2-;
(6)根据晶胞结构可知,与Q离子距离最近且距离相等的W离子是6个,构成的几何图形是正八面体,故答案为:正八面体.
点评 本题考查利用原子结构来推断元素,然后结合元素化合物知识及基本概念和基本理论来解答,注重了对高考热点的考查,并学会利用类推的方法来解题.

| A. | 硫酸铁可用作净水剂 | B. | 二氧化硅可用作计算机芯片 | ||
| C. | 铜制容器可用于盛装浓硝酸 | D. | 醋酸铅可用于分离提纯蛋白质 |
| A. | 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA | |
| B. | 常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.01NA | |
| C. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA | |
| D. | 7.8 g Na2O2中含有的阴离子数为0.2NA |
反应①aRO3-+bI-+cH+=dR-+eI2+fH2O
反应②I2+2Na2S2O3=2NaI+Na2S4O6
下列说法正确的是( )
| A. | b=c | |
| B. | R元素位于周期表的ⅤA族 | |
| C. | 滴定终点时,溶液的颜色由无色变为蓝色 | |
| D. | 若滴定消耗Na2S2O3溶液20.00mL,则反应①转移电子6.02×1020个 |
| 选项 | 表述Ⅰ | 表述Ⅱ |
| A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
| B | Cl2和SO2有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| D | SiO2有导电性 | SiO2可用于制备光导纤维 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 在Na2C2O4稀溶液中,c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| A. | 反应物的转化率 | B. | 反应体系的压强 | ||
| C. | 正、逆反应的速率 | D. | 反应混合物的浓度 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| C. | 由X、Y、Z、M四种元素共同形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
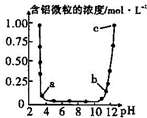 维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )
维持温度不变,向一定物质的量浓度的某AlCl3溶液中加入NaOH固体,忽略溶液体积的变化,溶液的pH与溶液中含铝微粒的物质的量浓度的关系如图.以下说法中正确的是( )| A. | a点表示溶液中的Al3+开始转化为Al(OH)3沉淀 | |
| B. | 据图可知,配制一定物质的量浓度的AlCl3溶液时,需要加入适量的H2SO4溶液抑制水解 | |
| C. | 当溶液的pH在6至8之间,铝元素全部以Al(OH)3的形式存在 | |
| D. | b点所对应的溶液中主要含铝微粒的水解程度大于c点 |