题目内容
【题目】某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
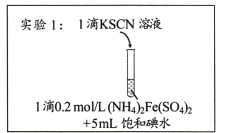
I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
编号 | 饱 和 (NH4)2Fe(SO4)2溶液 | 饱和碘水 | 石蜡油 | 操作 | KSCN溶液 | 现象 |
2-1 | 1滴 | 5mL | 1mL | 不加热 | 1滴 | 无明显现象 |
2-2 | 1滴 | 5mL | 1mL | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(1)研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为____。
(2)实验2中,加入石蜡油的目的是____。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是___。
II.查阅资料,继续探究
(资料)AgSCN为不溶于水的白色固体。
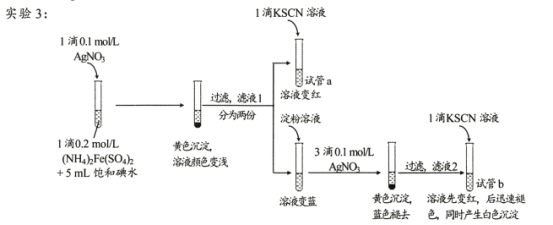
(4)试管a的实验现象说明滤液l中含有____。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是 ___。
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
编号 | 实验操作 | 实验现象 |
4 | 在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 | 溶液不变红 |
①试剂a是 ___。
②依据实验4,甲同学做出判断:______________________
(7)根据实验1~4所得结论是____。
【答案】2Fe3++2I-2Fe2++I2 隔绝空气中的O2,防止O2氧化Fe2+ 实验2中,采取了增大反应物浓度、升高温度的措施提高化学反应速率,但溶液仍未变红 Fe3+ 加入KSCN后,Fe3+先与SCN-反应生成Fe(SCN)3,溶液变红;Ag+与SCN-反应生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动,红色褪去,产生白色沉淀 0.1mol/LAgNO3溶液 假设ⅰ、ⅱ均不成立 实验1溶液未变红是因为2Fe2++I22Fe3++2I-的限度很小,溶液中Fe3+浓度太低,未能检出
【解析】
I.(1)Fe3+具有强氧化性,I-具有还原性。Fe3+与I-发生氧化还原反应
(2) 实验2中,石蜡密度小不溶于水,加入石蜡油的目的是隔绝空气中的O2。
(3) 反应速率不是导致实验1中溶液未变红的主要原因可以从对比试验来分析。
(4) 试管a的加入1滴KSCN溶液变红色说明含有Fe3+
(5) Fe3++3SCN- Fe(SCN)3 是可逆反应,从平衡移动的角度来分析
(6) 设计实验验证氧化Fe2+的物质
I.(1)Fe3+具有强氧化性,I-具有还原性。Fe3+与I-发生氧化还原反应的离子方程式为2Fe3++2I-2Fe2++I2
(2)实验2中,石蜡密度小不溶于水,加入石蜡油后浮在水面隔绝空气中的O2,防止O2氧化Fe2+。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是采取了增大反应物浓度、升高温度的措施提高化学反应速率,但溶液仍未变红。Ag+与SCN-反应生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动,红色褪去,产生白色沉淀 。
(7) II.(4)试管a的加入1滴KSCN溶液变红色说明含有Fe3+
(5). 加入KSCN后,Fe3+先与SCN-反应生成Fe(SCN)3,溶液变红;Ag+与SCN-反应生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动,红色褪去,产生白色沉淀
(6)①需要验证是否是AgNO3氧化了Fe2+,所以试剂a是0.1mol/LAgNO3溶液
②依据实验4,甲同学做出判断②依据实验4,甲同学做出判断
(7)根据实验1~4所得结论是实验1溶液未变红是因为2Fe2++I22Fe3++2I-的限度很小,溶液中Fe3+浓度太低,未能检出。