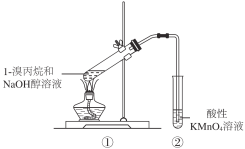
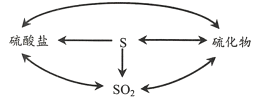
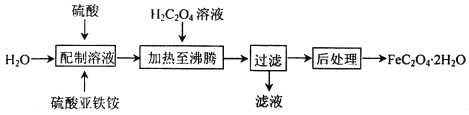
��Ŀ����
����Ŀ����ϩ�棨CH2=CHCN����һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ�������ϩ������������������Ҫ�������б�ϩȩ��CH2=CHCHO�������棨CH3CN���ȣ��ش��������⣺
(1)�Ա�ϩ����������Ϊԭ�ϣ��ڴ������������ɱ�ϩ�棨C3H3N���������ϩȩ��C3H4O�����Ȼ�ѧ����ʽ���£�
��C3H6(g)+NH3(g)+![]() O2(g)=C3H3N(g)+3H2O(g) ��H=-515kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ��H=-515kJ/mol
��C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ��H=-353kJ/mol
������Ӧ������ѧ�����ƾ��ܴ���ԭ����________����������߱�ϩ��ƽ����ʵķ�Ӧ������________����߱�ϩ�淴Ӧѡ���ԵĹؼ�������________��
(2)ͼ��a��Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ�¶�Ϊ460�档����460��ʱ����ϩ��IJ���________����ǡ����ߡ����ǡ�����Ӧ�¶��µ�ƽ����ʣ��ж�������________������460��ʱ����ϩ����ʽ��͵Ŀ���ԭ����________��˫ѡ�����ţ�
A���������Խ���B��ƽ�ⳣ�����C������Ӧ����D����Ӧ�������
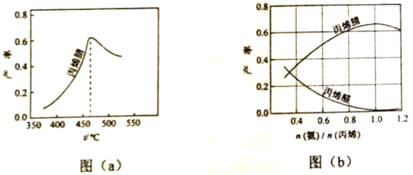
(3)��ϩ��ͱ�ϩȩ�IJ�����n������/n����ϩ���Ĺ�ϵ��ͼ��b����ʾ����ͼ��֪�����n������/n����ϩ��ԼΪ1������_______________�����ϰ�����������ϩ���������ԼΪ________��
���𰸡�������Ӧ��Ϊ��������ķ�Ӧ �����¶�,����ѹǿ,���� ���� �÷�ӦΪ���ȷ�Ӧ��ƽ�����Ӧ���¶����߶����� AC 1 �ñ����±�ϩ�������ߣ����������ϩȩ������� 1��7.5��1
��������
(1)�����Ȼ�ѧ����ʽ�����֪��������Ӧ������������Ӧ������������������������ѧ���ƴ���������߱�ϩ��ƽ�������Ҫ�ı�����ʹƽ��������У���߱�ϩ�淴Ӧѡ���ԵĹؼ������Ǵ�����
(2)��Ϊ�÷�ӦΪ���ȷ�Ӧ��ƽ�����Ӧ���¶����߶����ͣ�������460��ʱ����Ӧ�¶��µ�ƽ��ת��������Ӧ�����½��ģ���ʵ�������������ģ�����жϵ���460��ʱ����ϩ��IJ��ʲ��Ƕ�Ӧ�¶��µ�ƽ��ת���ʣ����ʽ�����Ҫ�Ӳ��ʵ�Ӱ�����ؽ��п��ǣ�
(3)����ͼ���֪����n������/n����ϩ��ԼΪ1ʱ���ñ����±�ϩ�������ߣ����������ϩȩ������ͣ����ݻ�ѧ��Ӧ��������������ϩ��1��1.5��1������ȼ��뷴Ӧ�ﵽ���״̬�����������ڿ�����Լռ20%���������ȡ�
(1)������Ӧ������ѧ�����ƾ��ܴ�������Ӧ������������Ӧ������������������������ѧ���ƴ÷�ӦΪ�����������ķ��ȷ�Ӧ�����Խ����¶ȡ�����ѹǿ��������߱�ϩ���ƽ����ʣ���߱�ϩ�淴Ӧѡ���ԵĹؼ������Ǵ�����
(2)��Ϊ�÷�ӦΪ���ȷ�Ӧ��ƽ�����Ӧ���¶����߶����ͣ�������460��ʱ����Ӧ�¶��µ�ƽ��ת��������Ӧ�����½��ģ���ʵ�������������ģ�����жϵ���460��ʱ����ϩ��IJ��ʲ��Ƕ�Ӧ�¶��µ�ƽ��ת���ʣ�����460��Cʱ����ϩ����ʽ��ͣ�
A��������һ���¶ȷ�Χ�ڻ��Խϸߣ����¶ȹ��ߣ����Խ��ͣ�A��ȷ��
B���÷�Ӧ���ȣ������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С��B����
C���������⣬�������б�ϩȩ���������Խ��ͣ�����Ӧ���࣬���²����½���C��ȷ��
D����Ӧ��ܵĴ�С��Ӱ��ƽ�⣬D����
����AC�������⣻
(3)����ͼ���֪����n������/n����ϩ��ԼΪ1ʱ���ñ����±�ϩ�������ߣ����������ϩȩ������ͣ����ݷ�ӦC3H6(g)+NH3(g)+![]() O2(g)=C3H3N(g)+3H2O(g)����������������ϩ��1��1.5��1������ȼ��뷴Ӧ�ﵽ���״̬��������������Լռ20%�����Խ��ϰ�����������ϩ���������ԼΪ��1��
O2(g)=C3H3N(g)+3H2O(g)����������������ϩ��1��1.5��1������ȼ��뷴Ӧ�ﵽ���״̬��������������Լռ20%�����Խ��ϰ�����������ϩ���������ԼΪ��1��![]() ��1=1��7.5��1��
��1=1��7.5��1��

����Ŀ��ij�о�С��������Ϸ���Fe3+��I-�ķ�Ӧ���п����ԣ��Ʋ��������뱥�͵�ˮ�Ļ��Һ�л����Fe3+�����ݴ����ʵ��1������ͼ��ʾ����������Һδ��졣��С�����Һδ����ԭ�����������̽����
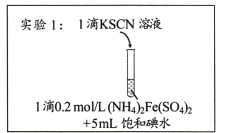
I������̽��
ʵ��2���������ȴ�������ˮ�����������ֱ�����Һ����ʵ�飬ʵ���¼���±���
��� | �� �� ��NH4��2Fe��SO4��2��Һ | ���͵�ˮ | ʯ���� | ���� | KSCN��Һ | ���� |
2-1 | 1�� | 5mL | 1mL | ������ | 1�� | ���������� |
2-2 | 1�� | 5mL | 1mL | ����һ��ʱ�����ȴ | 1�� | ���������� |
(1)�о�С��ͬѧ��������������д����Fe3+��I-��Ӧ�����ӷ���ʽΪ____��
(2)ʵ��2�У�����ʯ���͵�Ŀ����____��
(3)С��ͬѧ�����ƶϣ���Ӧ���ʲ��ǵ���ʵ��1����Һδ������Ҫԭ�����ǵ�������___��
II���������ϣ�����̽��
�����ϣ�AgSCNΪ������ˮ�İ�ɫ���塣
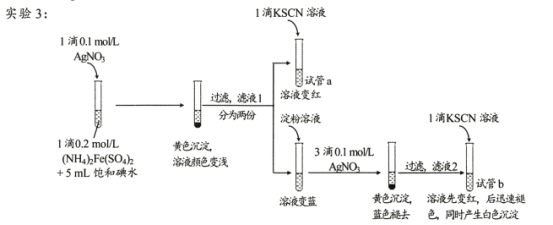
(4)�Թ�a��ʵ������˵����Һl�к���____��
(5)�Թ�b�У�����KSCN��Һ��������ʵ�������ԭ���� ___��
(6)��ͬѧ��ʵ��3��������ɣ���Ϊ��ʵ��������֤��I2������Fe2+����������¼��裺i��������AgNO3������Fe2+;ii�������ǿ����е�O2������Fe2+�� ����ơ�ʵʩ��ʵ��4��ʵ���¼���±���
��� | ʵ����� | ʵ������ |
4 | ���Թ��м���1��0.2mol/L��NH4��2Fe��SO4��2��Һ��5mL����ˮ��1���Լ�a��һ��ʱ������1��KSCN��Һ | ��Һ����� |
���Լ�a�� ___��
������ʵ��4����ͬѧ�����жϣ�______________________
(7)����ʵ��1��4���ý�����____��
����Ŀ��Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ���������������Ҫ�ɷ�ΪFeTiO3������������MgO��SiO2�����ʣ����Ʊ��������������£�
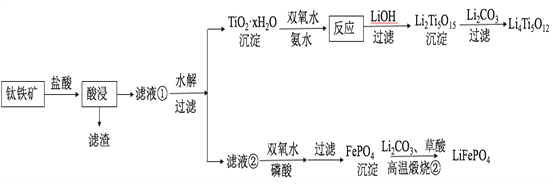
�ش��������⣺
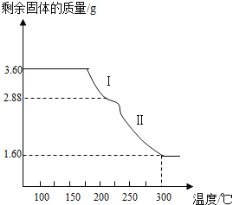
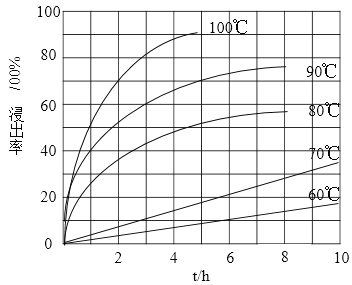
��1���������ʵ���У����Ľ����ʽ������ͼ��ʾ����ͼ��֪�������ľ�����Ϊ70%ʱ�������õ�ʵ������Ϊ___________________��
��2���������������Ҫ��TiOCl42����ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ__________________��
��3��TiO2��xH2O������˫��ˮ����ˮ��Ӧ40 min����ʵ�������±���ʾ��
�¶�/�� | 30 | 35 | 40 | 45 | 50 |
TiO2��xH2Oת����% | 92 | 95 | 97 | 93 | 88 |
����40��ʱTiO2��xH2Oת������ߵ�ԭ��__________________��
��4��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ__________________��
��5��������Һ�ڡ���c(Mg2+)=0.02 mol/L������˫��ˮ�����ᣨ����Һ�������1������ʹFe3+ǡ�ó�����ȫ����Һ��c(Fe3+)=1��10-5 mol/L����ʱ�Ƿ���Mg3(PO4)2�������ɣ�___________����ʽ���㣩��
FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ1.3��10-22��1.0��10-24��
��6��д�����������բڡ�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ______��