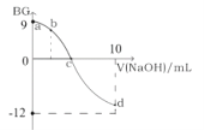
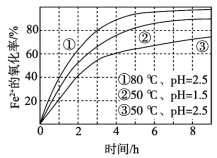
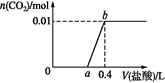
题目内容
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e,可生成标准状况下N2的体积为35.84 L
【答案】C
【解析】
A.在反应中,叠氮化钠里氮的化合价由-1/3价升高到0价,KNO3中的氮由+5价也降到了0价。所以NaN3是还原剂,硝酸钾是氧化剂,A错误;
B.氧化产物和还原产物都是氮气。16mol N2中有1mol N2来自硝酸钾,15molN2来自于NaN3,所以氧化产物与还原产物的物质的量之比为15∶1,B错误;
C.硝酸钾中的氮原子全部被还原,所以硝酸钾的物质的量和被还原的氮原子的物质的量相等。50.5克硝酸钾即0.5mol KNO3参加反应,那么被还原的N即为0.5mol,C正确;
D.从反应可以看出,每转移10mol电子,生成16mol N2,所以转移1mol电子,就会生成1.6mol N2,标准状况下为35.84L,D错误;
故合理选项为C。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
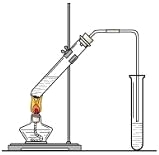
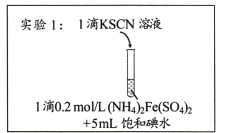
同步拓展阅读系列答案【题目】某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
编号 | 饱 和 (NH4)2Fe(SO4)2溶液 | 饱和碘水 | 石蜡油 | 操作 | KSCN溶液 | 现象 |
2-1 | 1滴 | 5mL | 1mL | 不加热 | 1滴 | 无明显现象 |
2-2 | 1滴 | 5mL | 1mL | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(1)研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为____。
(2)实验2中,加入石蜡油的目的是____。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是___。
II.查阅资料,继续探究
(资料)AgSCN为不溶于水的白色固体。
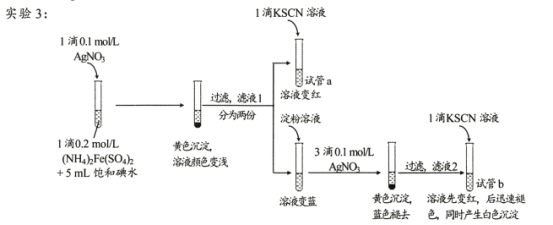
(4)试管a的实验现象说明滤液l中含有____。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是 ___。
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
编号 | 实验操作 | 实验现象 |
4 | 在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 | 溶液不变红 |
①试剂a是 ___。
②依据实验4,甲同学做出判断:______________________
(7)根据实验1~4所得结论是____。
【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D