题目内容
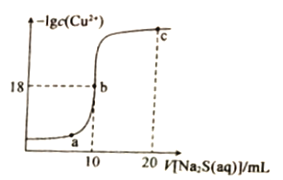
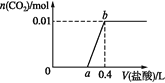
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
【答案】C
【解析】
向氢氧化钠和碳酸钠的混合溶液中滴加盐酸,依次发生:H+和OH-的酸碱中和反应,H++CO32-=HCO3-,最后HCO3-+H+=H2O+CO2↑。生成的气体是0.01mol,所以碳酸氢根离子是0.01mol,根据碳守恒,Na2CO3为0.01mol。
A.在0~a范围内,除了发生酸碱中和,还发生H++CO32-=HCO3-,A错误;
B.ab段发生的反应是HCO3-+H+=H2O+CO2↑,B错误;
C. 0.01mol HCO3-消耗0.01mol H+,根据盐酸浓度0.1mol/L,从a到0.4消耗的盐酸为0.1L,所以a等于0.3,C正确;
D. a=0.3,在前两个反应中,共消耗0.03mol HCl,0.01mol Na2CO3消耗0.01mol HCl生成HCO3-,那么OH-消耗0.02mol H+,所以OH-为0.02mol,所以氢氧化钠和碳酸钠的物质的量之比是2:1,D错误;
故选C。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】现有甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时 间长短来探究影响 H2O2 分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方 案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 25 ℃ | 三氧化二铁 | 10 mL 5% H2O2 |
甲组实验Ⅱ | 25 ℃ | 二氧化锰 | 10 mL 5% H2O2 |
甲、乙两小组得出如下图数据。

(1)甲小组实验得出的结论是_____。
(2) 由乙组研究的酸、碱对 H2O2 分解影响因素的数据分析,相同条件下 H2O2 在______(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2 固体与硫酸溶液反应制 H2O2,其反应的离子方程式为___________________________;支持这一方案的理由是_____。
(3)已知过氧化氢是一种极弱的二元酸:H2O2![]() H++HO2- (Ka1=2.4×10-12)。当稀 H2O2溶液在碱性环境下分解时会发生反应 H2O2+OH-
H++HO2- (Ka1=2.4×10-12)。当稀 H2O2溶液在碱性环境下分解时会发生反应 H2O2+OH-![]() HO2-+H2O,该反应中,正反应速率为 v 正=k正·c(H2O2)·c(OH-),逆反应速率为 v 逆=k 逆·c(H2O)·c(HO2- ),其中 k 正、k 逆为速率常数,则 k 正与 k 逆的比值为_________________________________________(保留 3 位有效数字)。
HO2-+H2O,该反应中,正反应速率为 v 正=k正·c(H2O2)·c(OH-),逆反应速率为 v 逆=k 逆·c(H2O)·c(HO2- ),其中 k 正、k 逆为速率常数,则 k 正与 k 逆的比值为_________________________________________(保留 3 位有效数字)。