题目内容
20.重水的组成是D216O,则1mol重水中含质子10NA个,1g重水中含电子0.5NA个,10g重水含中子5NA个.10个重水分子与10个普通水分子其质量之比是10:9,物质的量之比是1:1,质子数之比是1:1,中子数之比是5:4.分析 1个D216O分子中含2+8=10个质子,10个电子、10个中子,结合n=$\frac{m}{M}$及分子构成计算.
解答 解:1个D216O分子中含2+8=10个质子,10个电子、10个中子,则1mol重水中含质子10mol×NA=10NA个,1g重水中含电子$\frac{1g}{20g/mol}$×10×NA=0.5NA个,10g重水含中子$\frac{10g}{20g/mol}$×10×NA=5NA个.10个重水分子与10个普通水分子其质量之比等于相对分子质量之比,是20:18=10:9,物质的量之比等于个数比是1:1,质子数之比是10×10:10×10=1:1,中子数之比是10×10:10×8=5:4,
故答案为:10NA;0.5NA;5NA;10:9;1:1;1:1;5:4.
点评 本题考查物质的量的计算,为高频考点,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,注意水与重水中的中子数不同,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
17.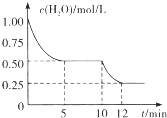 在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得
在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得
c( H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
 在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得
在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得c( H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
| A. | 0-5 min内,v(H2)=0.05 mol/(L.min) | |
| B. | 5 min时该反应的K值一定小于12 min时的K值 | |
| C. | 10 min时,改变的外界条件可能是减小压强 | |
| D. | 5 min时该反应的v正大于11 min时的v逆 |
11.下列各组粒子中,所含化学键类型有差异的是( )
| A. | CCl4 和CH2Cl2 | B. | H3O+ 和NH4+ | C. | CaO2 和 CaF2 | D. | Ba(0H)2 和NaOH |
8.改变反应物的用量,下列反应不能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥C与O2的反应.
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥C与O2的反应.
| A. | ①②③⑤ | B. | ①③④ | C. | ①③④⑥ | D. | ①③④⑤⑥ |
15. 如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
 如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是AgNO3稀溶液 | D. | A是Ag,B是Fe,C是AgNO3稀溶液 |
5.某铁矿石样品的主要成分为铁的氧化物,还含有少量SiO2.某化学兴趣小组对该铁矿石中铁元素的价态及含量进行如下探究:
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
③问题讨论:
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量样品于试管中,滴加适量的1mol?L-1H2SO4溶液,加热溶解,得到A溶液 | |
| 步骤2: | 若高锰酸钾溶液紫红色褪去,则样品中含+2价的铁元素 |
| 步骤3: | 若溶液变红色,则样品中含+3价的铁元素 |
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
12.设NA为阿伏加德罗常数的值,标准状况下O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
| A. | $\frac{22.4nb}{m{N}_{A}}$L | B. | $\frac{22.4mb}{n{N}_{A}}$ L | C. | $\frac{22.4n{N}_{A}}{mb}$ L | D. | $\frac{nb{N}_{A}}{22.4m}$ L |
9.向一定浓度的下列物质的澄清溶液中通入过量的CO2气体,最后肯定没有沉淀生成的是( )
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 ⑤Na2SiO3.
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 ⑤Na2SiO3.
| A. | ①③④ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
10.下列叙述正确的是( )
| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |