题目内容
10.下列叙述正确的是( )| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
分析 A.硫酸为强酸,阳离子与阴离子为2:1,稀释100倍后,溶液仍为酸性,阳离子与阴离子仍为2:1;
B.由水电离的c(H+)=10-12mol/L的溶液,为酸或碱溶液;
C.酸溶液的pH不超过7;
D.pH=1的H2SO4溶液,c(H+)=0.1mol/L,pH=12的NaOH溶液c(OH-)=1mol/L,呈中性,则n(H+)=n(OH-).
解答 解:A.硫酸为强酸,c(H+):c(SO42-)等于2:1,稀释100倍后,溶液仍为酸性,阳离子与阴离子仍为2:1,则稀释100倍后二者的比值几乎不变,故A正确;
B.由水电离的c(H+)=10-12mol/L的溶液,为酸或碱溶液,酸、碱均与HCO3-反应,一定不能大量共存,故B错误;
C.酸溶液的pH不超过7,则1.0×10-8mol/L盐酸的pH=7,故C错误;
D.pH=1的H2SO4溶液,c(H+)=0.1mol/L,pH=12的NaOH溶液c(OH-)=1mol/L,呈中性,则n(H+)=n(OH-),则两者的体积比为10:1,故D错误;
故选A.
点评 本题考查离子的共存及pH的计算,为综合题,把握电离、pH的计算、离子之间的反应为解答的关键,侧重分析与应用、计算能力的考查,题目难度中等.

练习册系列答案
相关题目
1.下列离子方程式正确的是( )
| A. | 铁和足量稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸钙和稀硝酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 稀硫酸和Ba(OH)2溶液反应:Ba2++H++SO42-+OH-═BaSO4↓+H2O | |
| D. | Cl2和FeCl2溶液反应:Cl2+Fe2+═Fe3++2Cl- |
18.常温下,下列各组离子在溶液中一定能大量共存的是( )
| A. | PH=2的溶液:K+、Na+、CH3COO-、CO32- | |
| B. | 与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3-、NO3- | |
| C. | 使酚酞呈红色的溶液中:Na+、K+、SiO32-、AlO2- | |
| D. | FeBr2溶液中滴加KI淀粉溶液变为蓝色 |
5.下列排列有错误的是( )
| A. | 粒子半径:F->Na+>Mg2+>Al3+ | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH |
19.能使淀粉碘化钾试纸变蓝的物质是( )
| A. | 氯水 | B. | 碘水 | C. | 碘化钠溶液 | D. | 溴化钠溶液 |
20.下列反应属于取代反应的是( )
| A. | 甲烷的燃烧 | B. | 由甲烷制取氯仿 | ||
| C. | 钠与水的反应 | D. | 硝酸银溶液与盐酸的反应 |
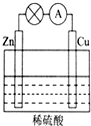 (1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
(1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g. 表示的分子式C6H14;名称是2甲基-戊烷.
表示的分子式C6H14;名称是2甲基-戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.