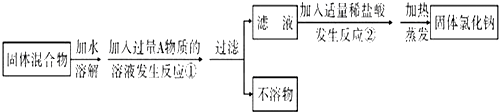
题目内容
17.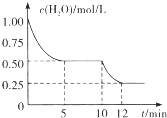 在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得
在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得c( H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
| A. | 0-5 min内,v(H2)=0.05 mol/(L.min) | |
| B. | 5 min时该反应的K值一定小于12 min时的K值 | |
| C. | 10 min时,改变的外界条件可能是减小压强 | |
| D. | 5 min时该反应的v正大于11 min时的v逆 |
分析 A.根据图可知,前5min内H2O的浓度由1.00mol/L减小为0.50mol/L,根据v=$\frac{△c}{△t}$计算c(H2O),再利用速率之比等于化学计量数之比计算v(H2);
B.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动,并且10min后反应速率大于前5分钟,则不是升压就是升温,平衡常数仅与温度有关;
C.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动;
D.根据B的判断,11 min时的温度高于5min时,根据温度越高反应速率越快.
解答 解:A.根据图可知,前5min内H2O的浓度由1.00mol/L减小为0.50mol/L,根据v=$\frac{△c}{△t}$=$\frac{1mol/L-0.5mol/L}{5min}$=0.1mol/(L•min),由化学计量数之比等于反应速率之比,则v(H2)=0.1mol/(L•min),故A错误;
B.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动,该反应正反应是吸热反应,所以是升高温度,所以5 min时该反应的K值一定小于12 min时的K值,故B正确;
C.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动,该反应正反应是吸热反应,所以是升高温度,故C错误;
D.根据B的判断,11 min时的温度高于5min时,根据温度越高反应速率越快,所以5 min时该反应的v正小于11 min时的v逆,故D错误;
故选B.
点评 本题考查化学平衡图象,涉及反应速率的计算、化学平衡的影响因素、化学平衡状态本质,难度中等,注意根据浓度变化判断可能改变的条件.

练习册系列答案
相关题目
7.有下列三个反应:①Cl2+FeI2═FeCl2+I2 ②2Fe2++Br2═2Fe3++2Br- ③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O下列说法正确的是( )
| A. | ①②③中的氧化产物分别是I2、Fe3+、CoCl2 | |
| B. | 根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 | |
| C. | 在③反应中当1molCo2O3参加反应时,2molHCl被氧化 | |
| D. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |
8.1L Na2SO4溶液中含Na+4.6g,则溶液中SO42-浓度为( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.6mol/L | D. | 0.4mol/L |
12.粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是( )
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②①④ |
2.“5•12”地震给四川等省市人民群众带来巨大的灾难.在灾区经常发生因混合使用消毒剂或洁污剂而产生的氯气中毒事件,据此推测,产生类似中毒事件的相混合的洁污剂或消毒剂中最有可能含有的离子或物质是( )
| A. | ClO3-,Cl-,K+ | B. | ClO-,Cl-,H+ | ||
| C. | NaClO,NaClO3,NaNO3 | D. | NaClO,Na2SO4,NaCl |
6.某同学欲配制符合下列条件的溶液,其中可能实现的是( )
| A. | 只含0.1 mol Na+、0.2 mol Mg2+、0.1 mol Cl-和0.1 mol NO3-的溶液 | |
| B. | 只含0.1 mol NH4+、0.1 mol Ca2+、0.1 mol CO32-和0.1 mol Cl-的溶液 | |
| C. | 为了通过测定pH的大小,达到比较HCl和CH3COOH酸性强弱的目的,分别配制100 mL 0.1 mol/L的NaCl溶液和CH3COONa溶液 | |
| D. | 仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液 |
 已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如图所示.其中,丁是一种红褐色沉淀,戊是一种白色沉淀.请回答下列问题:
已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如图所示.其中,丁是一种红褐色沉淀,戊是一种白色沉淀.请回答下列问题: