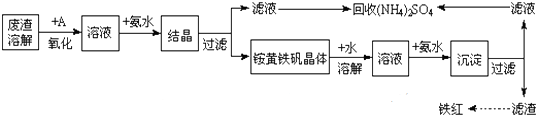
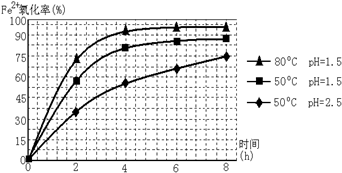
题目内容
18.一定条件下反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )| A. | 1mol•L-1•min-1 | B. | 1.2mol•L-1•min-1 | ||
| C. | 6mol•L-1•min-1 | D. | 0.41mol•L-1•min-1 |
分析 依据反应速率等于单位时间内物质浓度的变化计算氮气的反应速率v(N2)=$\frac{△c}{△t}$,速率之比等于化学方程式计量数之比计算氨气的反应速率.
解答 解:在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率v(N2)=$\frac{△c}{△t}$=$\frac{\frac{20mol-8mol}{10L}}{2min}$=0.6 mol/(L•min),反应速率之比等于化学方程式计量数之比v(NH3)=2v(N2)=2×0.6 mol/(L•min)=1.2mol/(L•min),故选B.
点评 本题考查了反应速率的定量表示方法化学反应速率的计算,反应速率之比等于化学方程式计量数之比,题目很简单,根据公式计算即可.

练习册系列答案
相关题目
9.下列反应不属于消去反应的是( )
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{乙醇}$CH3CH═CH2↑+NaBr+H2O | |
| C. | 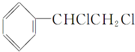 +2NaOH$→_{△}^{乙醇}$ +2NaOH$→_{△}^{乙醇}$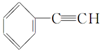 +2NaCl+2H2O +2NaCl+2H2O | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
6.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构.例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为:
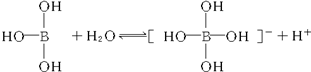
下列判断正确的是( )
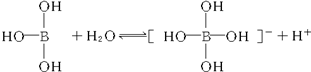
下列判断正确的是( )
| A. | 凡是酸或碱对水的电离都是抑制的 | |
| B. | 硼酸分子中除氢原子外每个其他原子最外层都满足8电子稳定结构 | |
| C. | 硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
13.对于10mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度; ②改用10mL 3mol/L盐酸; ③改用30mL 1mol/L醋酸;
④用等量锌粉代替锌粒; ⑤改用10mL 3mol/L硝酸.
①升高温度; ②改用10mL 3mol/L盐酸; ③改用30mL 1mol/L醋酸;
④用等量锌粉代替锌粒; ⑤改用10mL 3mol/L硝酸.
| A. | ①②④ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
3.向2L密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+2N(g)?E(g),当反应进行到4min时,测知M的浓度为0.2mol/L,则化学反应的平均速率( )
| A. | v(M)=0.4 mol/(L•min) | B. | v(N)=0.4 mol/(L•min) | ||
| C. | v(M)=0.8 mol/(L•min) | D. | v(E)=0.45 mol/(L•min) |
10.在${\;}_{m}^{n}$X${\;}_{q}^{p}$ 中,m、n、p、q表示某种元素X的四个角码,若X1与X2的q均为1,m、p的值相等,而n值不相等,则X1和X2表示的可能是( )
| A. | 不同的原子 | B. | 同一元素的不同原子或离子 | ||
| C. | 不同元素的离子 | D. | 不同的元素 |
7.有下列两组命题
B组命题正确且能用A组命题给以正确解释的是( )
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键能 Ⅱ.H-I键键能小于H-Cl键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | a.HI比HCl稳定 b.HCl比HI稳定 c.HI沸点比HCl高 d.HI沸点比HCl低 |
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
8.浓硫酸在与含有水分的蔗糖作用过程中没有显示的性质是( )
| A. | 强氧化性 | B. | 脱水性 | C. | 酸性 | D. | 吸水性 |