题目内容
6.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构.例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为: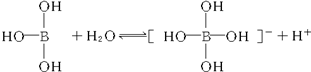
下列判断正确的是( )
| A. | 凡是酸或碱对水的电离都是抑制的 | |
| B. | 硼酸分子中除氢原子外每个其他原子最外层都满足8电子稳定结构 | |
| C. | 硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
分析 A、硼酸的电离结合了水溶液中的氢氧根离子;
B、根据硼酸电离出的氢离子的数目可以看出是几元酸;
C、硼酸能和OH-发生化合反应,而使中心原子最外层电子达到饱和结构.
D、硼酸是酸,电离出的阳离子全部是氢离子.
解答 解:A、硼酸在水中的电离过程为: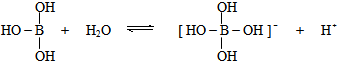 ,可以看出硼酸的电离结合了水溶液中的氢氧根离子,对水的电离起促进作用,故A错误;
,可以看出硼酸的电离结合了水溶液中的氢氧根离子,对水的电离起促进作用,故A错误;
B、硼酸电离出的氢离子的数目是1,可以,得出硼酸是一元酸,故B错误;
C、硼酸能和OH-发生化合反应,而使中心原子最外层电子达到饱和结构,即:H3BO3+OH-=[B(OH)4]-,故C正确;
D、硼酸电离出的阳离子全部是氢离子,属于酸,故D错误.
故选C.
点评 本题考查弱电解质在水溶液中的电离,为高频考点,正确获取信息并利用信息解答问题是解本题关键,侧重考查学生自学及知识迁移能力,题目难度中等.

练习册系列答案
相关题目
12.反应3NO2+H2O=2HNO3+NO中,当有4mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比是( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O.当产物n(NO2):n(NO)=1:1时,下列说法不正确的是( )
| A. | 反应中Cu2S只做还原剂 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 产物n[Cu(NO3)2]:n[CuSO4]=1:1 | |
| D. | 1 molCu2S参加反应时有10 mol电子转移 |
1.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 71g氯气与过量的FeCl2溶液完全反应转移的电子数为2NA | |
| B. | 1 mol甲基(-14CH3)所含中子数为9NA | |
| C. | 在标准状况下,2.24L四氯甲烷所含的分子数为0.1NA | |
| D. | 2L 0.1mol/L 的醋酸钠溶液中,所含离子总数是0.2NA |
11.已知X元素原子的L电子层比Y元素原子的L电子层少2个电子,Y元素原子核外电子总数比X元素核外电子总数多3个,则下列说法不正确的是( )
| A. | X与Y能形成两种化合物,但化学键类型不相同 | |
| B. | Y与氢形成化合物YH,分子内存在离子键 | |
| C. | X与氢可形成化合物H2X2,分子内部存在极性键和非极性键 | |
| D. | Y2X2中阴、阳离子个数比1:2 |
18.一定条件下反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )
| A. | 1mol•L-1•min-1 | B. | 1.2mol•L-1•min-1 | ||
| C. | 6mol•L-1•min-1 | D. | 0.41mol•L-1•min-1 |

 ;
; ;Ⅱ、D→E2
;Ⅱ、D→E2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O; .
.