题目内容
10.在${\;}_{m}^{n}$X${\;}_{q}^{p}$ 中,m、n、p、q表示某种元素X的四个角码,若X1与X2的q均为1,m、p的值相等,而n值不相等,则X1和X2表示的可能是( )| A. | 不同的原子 | B. | 同一元素的不同原子或离子 | ||
| C. | 不同元素的离子 | D. | 不同的元素 |
分析 m的值相等,且q为1,说明是同一种元素的不同种微粒,且不能是双原子分子,质子数相同,中子数不同的互为同位素,据此解答即可.
解答 解:m和p相等,n不等,可以表示的是同种元素的不同种原子,即同位素,可以表示的是同种元素的同种离子,故B正确;故选B.
点评 本题主要考查的是分子、原子和离子的关系以及核素的表示中各种符号的意义,m确定元素的种类、n确定原子的种类、p确定带电荷数、q表示个数,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 71g氯气与过量的FeCl2溶液完全反应转移的电子数为2NA | |
| B. | 1 mol甲基(-14CH3)所含中子数为9NA | |
| C. | 在标准状况下,2.24L四氯甲烷所含的分子数为0.1NA | |
| D. | 2L 0.1mol/L 的醋酸钠溶液中,所含离子总数是0.2NA |
18.一定条件下反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )
| A. | 1mol•L-1•min-1 | B. | 1.2mol•L-1•min-1 | ||
| C. | 6mol•L-1•min-1 | D. | 0.41mol•L-1•min-1 |
5.对于实验Ⅰ~Ⅳ的实验现象预测正确的是(


| A. | 实验Ⅰ:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验Ⅱ:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验Ⅲ:抽去中间玻璃片,瓶内没有任何现象 | |
| D. | 实验Ⅳ:BaCl2溶液变浑浊,品红溶液褪色 |
2.下列说法正确的是( )
| A. | 密闭容器中充入1mol N2和3mol H2可生成2mol NH3 | |
| B. | 改变条件不能改变可逆反应的限度 | |
| C. | 当某反应在一定条件下达到反应限度时即达到了化学平衡状态 | |
| D. | 当某反应达到限度时,反应物和生成物的浓度一定相等 |
19.Na、Fe、C、O、Si、Cl是中学化学中常见的六种元素.
(1)Si位于元素周期表第三周期第ⅣA族;Fe的基态原子外围电子层排布式为3d64s2.
(2)用“>”或“<”或元素符号填空:
(3)已知甲醇的燃烧热为726.5kJ/mol,写出甲醇燃烧的热化学方程式.CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+H2O(l)△H=-726.5kJ/mol.
(4)FeO42- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生.该反应的离子方程式为4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
(1)Si位于元素周期表第三周期第ⅣA族;Fe的基态原子外围电子层排布式为3d64s2.
(2)用“>”或“<”或元素符号填空:
| C、O、Si第一电离能 | 离子半径Cl-、Na+、O2- | 熔点 | 电负性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
(4)FeO42- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生.该反应的离子方程式为4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
20.化学与生活密切相关,下列说法不正确的是( )
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
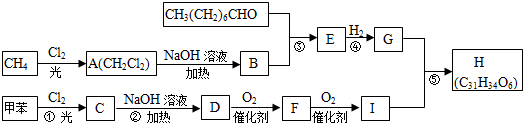
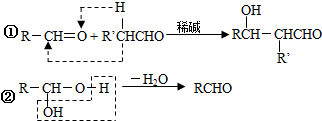
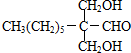 ;
;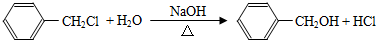 ;Ⅱ、D→E2
;Ⅱ、D→E2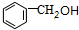 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2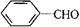 +2H2O;
+2H2O;