题目内容
7.有下列两组命题| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键能 Ⅱ.H-I键键能小于H-Cl键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | a.HI比HCl稳定 b.HCl比HI稳定 c.HI沸点比HCl高 d.HI沸点比HCl低 |
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
分析 根据键能越大,物质的热稳定性越强;根据组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高.
解答 解:①HCl比HI稳定,是由于H-Cl键键能大于H-I键键能,故①错误;
②HCl比HI稳定,是由于H-Cl键键能大于H-I键键能,故②正确;
③HI沸点比HCl高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力大于HCl分子间作用力,故③正确;
④HI沸点比HCl高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力大于HCl分子间作用力,故④错误;故选B.
点评 本题主要考查了键能与物质的热稳定性、相对分子质量与物质的熔沸点之间的关系,掌握规律是解题的关键.

练习册系列答案
相关题目
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O.当产物n(NO2):n(NO)=1:1时,下列说法不正确的是( )
| A. | 反应中Cu2S只做还原剂 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 产物n[Cu(NO3)2]:n[CuSO4]=1:1 | |
| D. | 1 molCu2S参加反应时有10 mol电子转移 |
18.一定条件下反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )
| A. | 1mol•L-1•min-1 | B. | 1.2mol•L-1•min-1 | ||
| C. | 6mol•L-1•min-1 | D. | 0.41mol•L-1•min-1 |
2.下列说法正确的是( )
| A. | 密闭容器中充入1mol N2和3mol H2可生成2mol NH3 | |
| B. | 改变条件不能改变可逆反应的限度 | |
| C. | 当某反应在一定条件下达到反应限度时即达到了化学平衡状态 | |
| D. | 当某反应达到限度时,反应物和生成物的浓度一定相等 |
12.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-→2Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大 |
19.Na、Fe、C、O、Si、Cl是中学化学中常见的六种元素.
(1)Si位于元素周期表第三周期第ⅣA族;Fe的基态原子外围电子层排布式为3d64s2.
(2)用“>”或“<”或元素符号填空:
(3)已知甲醇的燃烧热为726.5kJ/mol,写出甲醇燃烧的热化学方程式.CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+H2O(l)△H=-726.5kJ/mol.
(4)FeO42- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生.该反应的离子方程式为4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
(1)Si位于元素周期表第三周期第ⅣA族;Fe的基态原子外围电子层排布式为3d64s2.
(2)用“>”或“<”或元素符号填空:
| C、O、Si第一电离能 | 离子半径Cl-、Na+、O2- | 熔点 | 电负性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
(4)FeO42- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生.该反应的离子方程式为4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
17.已知维生素A的结构简式如图,关于它的说法正确的是( )
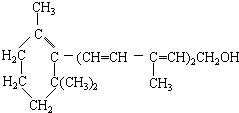
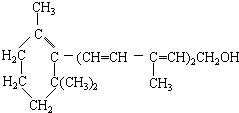
| A. | 维生素A分子含有氢原子数为奇数 | |
| B. | 维生素A的分子中含有苯环结构 | |
| C. | 1mol维生素A在催化剂作用下,可以和5molH2完全加成 | |
| D. | 维生素A属于醇,是一种水溶性维生素,可以发生消去反应 |

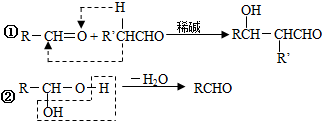
 ;
; ;Ⅱ、D→E2
;Ⅱ、D→E2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O; .
.