题目内容
3.向2L密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+2N(g)?E(g),当反应进行到4min时,测知M的浓度为0.2mol/L,则化学反应的平均速率( )| A. | v(M)=0.4 mol/(L•min) | B. | v(N)=0.4 mol/(L•min) | ||
| C. | v(M)=0.8 mol/(L•min) | D. | v(E)=0.45 mol/(L•min) |
分析 4min时M的浓度为0.2mol/L,那么以M表示的化学反应速率可以计算,然后利用化学反应速率之比等于化学计量数之比确定以N个E表示的速率即可.
解答 解:依据题意得出:v(M)=$\frac{\frac{2mol}{2L}-0.2mol/L}{4min}$=0.2mol/(L•min),由于发生反应:M(g)+2N(g)?E(g),故v(N)=2v(M)=0.4mol/(L•min),v(E)=v(M)=0.2mol/(L•min),故B正确,故选B.
点评 本题主要考查的是有关化学反应速率的计算,熟练掌握化学反应速率是单位时间浓度的变化量以及化学反应速率与化学计量数的关系,难度不大.

练习册系列答案
相关题目
13.卤代烃与金属镁在无水乙醚中反应,可得格氏试剂R-MgX,它可与醛、酮等羰基化合物加成: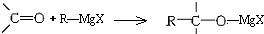 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
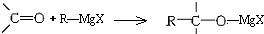 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )| A. | 乙醛和氯乙烷 | B. | 甲醛和1-溴丙烷 | C. | 甲醛和2-溴丙烷 | D. | 丙酮和一氯甲烷 |
11.已知X元素原子的L电子层比Y元素原子的L电子层少2个电子,Y元素原子核外电子总数比X元素核外电子总数多3个,则下列说法不正确的是( )
| A. | X与Y能形成两种化合物,但化学键类型不相同 | |
| B. | Y与氢形成化合物YH,分子内存在离子键 | |
| C. | X与氢可形成化合物H2X2,分子内部存在极性键和非极性键 | |
| D. | Y2X2中阴、阳离子个数比1:2 |
18.一定条件下反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )
| A. | 1mol•L-1•min-1 | B. | 1.2mol•L-1•min-1 | ||
| C. | 6mol•L-1•min-1 | D. | 0.41mol•L-1•min-1 |
12.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-→2Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大 |
13.X、Y、Z均为短周期元索,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 单质活泼性:X>Y>Z | ||
| C. | 原子序数:X>Y>Z | D. | 离子半径:X2->Y+>Z- |
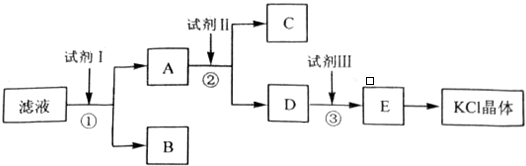

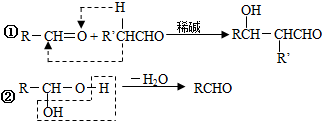
 ;
; ;Ⅱ、D→E2
;Ⅱ、D→E2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;