题目内容
13.对于10mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )①升高温度; ②改用10mL 3mol/L盐酸; ③改用30mL 1mol/L醋酸;
④用等量锌粉代替锌粒; ⑤改用10mL 3mol/L硝酸.
| A. | ①②④ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
分析 增大反应速率,可增大固体表面积、升高温度,增大浓度,加入催化剂或形成原电池反应等,以此解答该题.
解答 解:①升高温度,活化分子百分数增大,反应速率增大,故正确;
②改用10mL 3mol/L盐酸,浓度增大,反应速率增大,故正确;
③改用30mL 1mol/L醋酸,醋酸是弱酸不能完全电离,因浓度不变,醋酸中氢离子浓度小,所以反应速率减慢,故错误;
④用等量锌粉代替锌粒,固体表面积增大,反应速率增大,故正确;
⑤硝酸与锌粒反应不生成氢气,故错误;
故选A.
点评 本题考查化学反应速率的影响,侧重于基本理论知识的理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
3.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
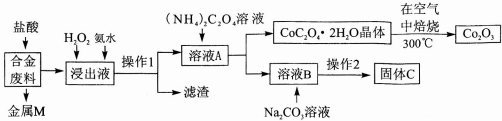
(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+2CO2↑.

(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol•L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
4. NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
 NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )| A. | 0℃时,饱和的NaCl和NH4Cl混合溶液中,NaCl的物质的量浓度是NH4Cl的2倍 | |
| B. | 30℃时,饱和的NaCl和NH4Cl混合溶液中,两者的物质的量浓度相等 | |
| C. | 通入的气体可能是NH3,控制在0~10℃结晶出NH4Cl | |
| D. | 通入的气体可能是CO2,控制在30~40℃结晶出NH4Cl |
1.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 71g氯气与过量的FeCl2溶液完全反应转移的电子数为2NA | |
| B. | 1 mol甲基(-14CH3)所含中子数为9NA | |
| C. | 在标准状况下,2.24L四氯甲烷所含的分子数为0.1NA | |
| D. | 2L 0.1mol/L 的醋酸钠溶液中,所含离子总数是0.2NA |
8.下列排序不正确的是( )
| A. | 稳定性 PH3<H2S<HCl | B. | 沸点高低 NH3<PH3<AsH3 | ||
| C. | 还原性 Br-<Fe2+<I- | D. | 微粒半径 K+<Cl?<S2? |
18.一定条件下反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )
| A. | 1mol•L-1•min-1 | B. | 1.2mol•L-1•min-1 | ||
| C. | 6mol•L-1•min-1 | D. | 0.41mol•L-1•min-1 |
5.对于实验Ⅰ~Ⅳ的实验现象预测正确的是(
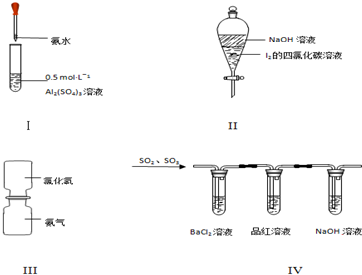

| A. | 实验Ⅰ:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验Ⅱ:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验Ⅲ:抽去中间玻璃片,瓶内没有任何现象 | |
| D. | 实验Ⅳ:BaCl2溶液变浑浊,品红溶液褪色 |
2.下列说法正确的是( )
| A. | 密闭容器中充入1mol N2和3mol H2可生成2mol NH3 | |
| B. | 改变条件不能改变可逆反应的限度 | |
| C. | 当某反应在一定条件下达到反应限度时即达到了化学平衡状态 | |
| D. | 当某反应达到限度时,反应物和生成物的浓度一定相等 |
3.海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如反渗透法、电渗析法、离子交换法等,下列方法中也是用来进行海水淡化的是( )
| A. | 过滤法 | B. | 萃取法 | C. | 分液法 | D. | 蒸馏法 |