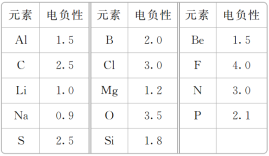
题目内容
【题目】向2 L的密闭容器中充入1mol A和1mol B,反应 A(g) + B(g)C(g) + D(g) ΔH的平衡常数(K)和温度(T)的关系如下:
温度/ ℃ | 700 | 800 | 900 |
平衡常数 | 0.1 | X | 1 |
800℃时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04 mol/(L·s)。下列说法不正确的是
A.平衡时,c(B)为0.6 mol·L-1
B.800℃时平衡常数X=4/9
C.ΔH >0
D.900℃该反应达到平衡状态时,A的物质的量为0.5 mol
【答案】A
【解析】
A.800℃时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04 mol/(L·s),5s内B的浓度变化是0.04 mol/(L·s)×5s=0.2 mol/L,平衡时,c(B)为![]() ,故A错误;
,故A错误;
B.
800℃时平衡常数X=![]() 4/9,故B正确;
4/9,故B正确;
C.A(g) + B(g)C(g) + D(g)反应的平衡常数随温度升高而增大,所以ΔH >0,故C正确;
D.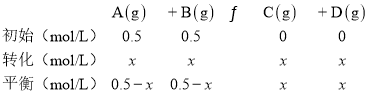 ,900℃的平衡常数是1,则
,900℃的平衡常数是1,则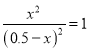 ,x=0.25,该反应达到平衡状态时,A的物质的量浓度为0.25mol/L,A的物质的量为0.25mol/L×2L =0.5 mol,故D正确;
,x=0.25,该反应达到平衡状态时,A的物质的量浓度为0.25mol/L,A的物质的量为0.25mol/L×2L =0.5 mol,故D正确;
选A。

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目