题目内容
【题目】下表给出了14种元素的电负性:

运用元素周期律知识完成下列各题。
(1)同一周期中,从左到右,主族元素的电负性________;同一主族中,从上到下,元素的电负性________。所以主族元素的电负性随原子序数递增呈____________变化。
(2)短周期元素中,电负性最大的元素与氢元素形成的化合物属于________化合物,用电子式表示该化合物的形成过程__________________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键。则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是________,为共价化合物的是________。
【答案】逐渐增大 逐渐减小 周期性 共价 ![]() +
+ ![]()
![]()
![]() Mg3N2 BeCl2、AlCl3、SiC
Mg3N2 BeCl2、AlCl3、SiC
【解析】
根据表格电负性大小关系得出同一周期,同一主族的电负性变化规律;短周期元素中,电负性最大的元素为F根据电负性差值来判断离子化合物还是共价化合物。
(1)同一周期中,从左到右,主族元素的电负性逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小。所以主族元素的电负性随原子序数递增呈周期性变化;故答案为:逐渐增大;逐渐减小;周期性。
(2)短周期元素中,电负性最大的元素为F,与氢元素形成的化合物(HF)属于共价化合物,用电子式表示该化合物的形成过程![]() +
+ ![]()
![]()
![]() ;故答案为:共价;
;故答案为:共价;![]() +
+ ![]()
![]()
![]() 。
。
(3)Mg3N2:两者电负性之差3.0-1.2=1.8>1.7,是离子化合物;BeCl2:两者电负性之差3.0-1.5=1.5<1.7,是共价化合物;AlCl3:两者电负性之差3.0-1.5=1.5<1.7,是共价化合物;SiC:两者电负性之差2.5-1.8=0.7<1.7,是共价化合物;因此为离子化合物的是Mg3N2,为共价化合物的是BeCl2、AlCl3、SiC;故答案为:Mg3N2;BeCl2、AlCl3、SiC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
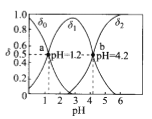
小学生10分钟应用题系列答案【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. 酸性强弱顺序是HCOOH>HCN> H2CO3
B. HCOOH的电离平衡常数表达式为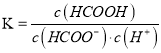
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-=HCO3-+HCN
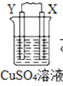
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
【题目】向2 L的密闭容器中充入1mol A和1mol B,反应 A(g) + B(g)C(g) + D(g) ΔH的平衡常数(K)和温度(T)的关系如下:
温度/ ℃ | 700 | 800 | 900 |
平衡常数 | 0.1 | X | 1 |
800℃时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04 mol/(L·s)。下列说法不正确的是
A.平衡时,c(B)为0.6 mol·L-1
B.800℃时平衡常数X=4/9
C.ΔH >0
D.900℃该反应达到平衡状态时,A的物质的量为0.5 mol
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:

资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。
【题目】下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3 可作防火剂 |
B | 将 H2 在充满Cl2 的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2 化合生成HCl |
C | 将 SO2 通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2 具有氧化性 |
D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A.AB.BC.CD.D