题目内容
【题目】已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是
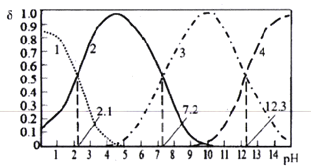
A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
【答案】B
【解析】
A.某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒为H3PO4、H2PO4-、HPO42-、PO43-,根据pH的变化,可知曲线1为H3PO4,曲线2为H2PO4-,曲线3为HPO42-,曲线4为PO43-,A项错误;
B. H3PO4的第一步电离常数K1=![]() ,25℃时当pH为2.1时,
,25℃时当pH为2.1时,![]() =
=![]() ,故K1=
,故K1=![]() =
=![]() 10-2.1,同理因H3PO4的第二步电离常数K2=
10-2.1,同理因H3PO4的第二步电离常数K2=![]() ,pH=7.2时,
,pH=7.2时, ![]() =
=![]() ,K2=
,K2=![]() =10-7.2,则K1:K2=10-2.1:10-7.2 = 105.1,B项正确;
=10-7.2,则K1:K2=10-2.1:10-7.2 = 105.1,B项正确;
C. pH = 7.2时,溶液中含磷微粒主要为:H2PO4-、HPO42-,此时溶液中的c(H+)=10-7.2 mol/L,水的电离受到一定程度的抑制, H2PO4-、HPO42-及水电离的氢离子浓度共10-7.2 mol/L,则溶液中由水电离出的c(H+)小于10-7.2mol/L,C项错误;
D. pH=12.3时,溶液中主要含Na3PO4与Na2HPO4,依据越弱越水解的原理可知,PO43-水解程度较HPO42-大,又因为此时![]() =
=![]() ,则说明Na3PO4与Na2HPO4并非相同浓度,故物料守恒式不正确,D项错误;
,则说明Na3PO4与Na2HPO4并非相同浓度,故物料守恒式不正确,D项错误;
答案选B。






