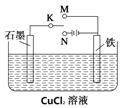
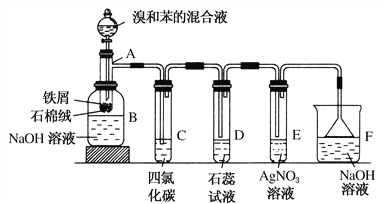
题目内容
【题目】四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质结构信息 | 人体内含量最多的元素,且其单质是常见的助燃剂。 | 单质为空气中含量最多的气体,该气体为双原子分子,分子中含有3对共用电子对。 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 第三周期的金属元素,其氧化物有两性。 |
(1)元素T的离子结构示意图_____;元素X的气态氢化物的电子式____;Y的最高价氧化物的水化物属于____化合物(填“离子”或“共价”)。
(2)Z的最高价氧化物对应水化物的电离方程式_________。
(3)元素Z与镁元素相比,金属性较强的是___(用元素符号表示),下列表述中不能证明这一事实的是_____。
a.氢氧化镁不溶于氢氧化钠,而氢氧化铝可溶于氢氧化钠
b.镁能置换出熔融氧化铝中的铝
c.镁能跟二氧化碳反应,而铝不能
d.等量的镁铝和足量的盐酸反应时,铝失电子的数目比镁多
【答案】![]()
![]() 离子 AlO2-+H++H2O
离子 AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH- 镁 cd
Al3++3OH- 镁 cd
【解析】
T为人体内含量最多的元素,且其单质是常见的助燃剂,则其为氧(O);X为单质且为空气中含量最多的气体,该气体为双原子分子,分子中含有3对共用电子对,则其为氮(N);Y为单质,质软、银白色固体、导电性强,单质在空气中燃烧发出黄色的火焰,则其为钠(Na);Z为第三周期的金属元素,其氧化物有两性,则其为铝(Al)。
(1)元素T为氧,其离子结构示意图为![]() 。答案为
。答案为![]()
元素X为氮,其气态氢化物的电子式为![]() 。答案为
。答案为![]()
Y为钠,其最高价氧化物的水化物为NaOH,属于离子化合物。答案为:离子
(2)Z为铝,其最高价氧化物对应水化物为Al(OH)3,
电离方程式为AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-
Al3++3OH-
答案为:AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-
Al3++3OH-
(3)元素Z为铝,与镁元素相比,金属性较强的是镁。答案为镁
a.氢氧化镁不溶于氢氧化钠,而氢氧化铝可溶于氢氧化钠,说明氢氧化铝能表现出酸的性质,也即氢氧化镁的碱性比氢氧化铝强,即金属性镁比铝强,符合题意;
b.镁能置换出熔融氧化铝中的铝,说明Mg能将Al3+还原为Al,则还原性Mg>Al,也即金属性Mg>Al,符合题意;
c.镁能跟二氧化碳反应,而铝不能与CO2气体反应,主要是铝极易氧化成致密的氧化铝保护膜,阻止铝与二氧化碳的进一步反应,所以不能由此确定镁和铝的还原性强弱,不合题意;
d.等量的镁铝和足量的盐酸反应时,虽然铝失电子的数目比镁多,但失电子数目的多少与金属的还原性没有必然的联系,不合题意。
故c、d选项不能证明镁的金属性比铝强。
答案为cd

 阅读快车系列答案
阅读快车系列答案【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA 表示阿伏加德罗常数)
消耗二氧化碳 | 生成碳酸钠 | 转移的电子 | |
A | 1 mol | 2NA | |
B | 22.4 L | 1 mol | |
C | 106 g | 1 mol | |
D | 106 g | 2NA |
A.AB.BC.CD.D