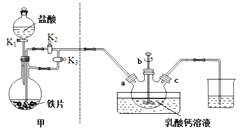
题目内容
【题目】下列说法正确的是( )
A.23gNO2与足量水反应,转移的电子数约为6.02×1023
B.标准状况下,22.4L15NH3含有的质子数约为6.02×1024
C.常温下,1L0.1mo1L-1NH4NO3溶液中含有的NH4+数约为6.02×1022
D.密闭容器中,1molNO与0.5molO2充分反应后,容器中分子数约为6.02×1023
【答案】B
【解析】
A. 23gNO2物质的量为0.5mol,与足量水反应的化学反应方程式为:3NO2+H2O=2HNO3+NO,其转移的电子数约为![]() ×6.02×1023,A错误;
×6.02×1023,A错误;
B. 标准状况下,22.4L15NH3的物质的量为1mol,含有的质子数约为6.02×1024,B正确;
C. NH4NO3是强酸弱碱盐,其溶液中NH4+水解生成氨水,NH4+数小于6.02×1022,C错误;
D. NO2中存在平衡:2NO2N2O4,所以密闭容器中1molNO与0.5molO2充分反应,产物的分子数小于6.02×1023,D错误;故答案为:B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目