题目内容
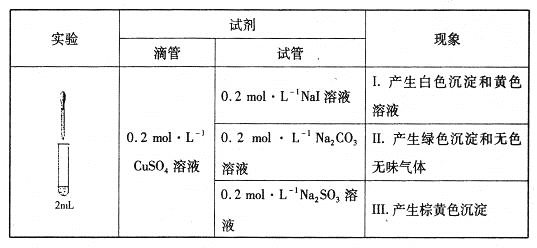
【题目】某课外活动小组用下图装置进行实验,试回答:
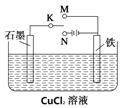
(1)若开始时K接M,则该装置为________(填“原电池”或“电解池”),铁极上的电极反应式为__________________。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),石墨电极的电极反应式为______________________,铁极上的现象为_____________,若反应过程中有0.2mol的电子发生转移,则铁电极上产生物质的质量为________g,石墨极上产生的物质在标准状况下的体积为_____________L。
【答案】原电池 Fe-2e-=Fe2+ 阳极 2Cl--2e-=Cl2 ↑ 有红色物质析出 6.4 2.24
【解析】
(1)若开始时K接M,为原电池装置,铁作负极失电子被氧化生成亚铁离子;
(2)若开始时K接N,为电解池装置,与电源正极相连的石墨电极为阳极,与电源负极相连的Fe电极为阴极,电解氯化铜溶液阳极析出氯气,阴极析出铜,电解氯化铜生成氯气和铜,结合电子守恒计算。
(1)若开始时K接M,为原电池装置,铁做负极失电子被氧化生成亚铁离子,铁极上的电极反应式为:Fe-2e-=Fe2+;
(2)若开始时K接N,为电解池装置,与电源正极相连的石墨电极为阳极,与电源负极相连的Fe电极为阴极。电解氯化铜溶液,阳极析出氯气,电极反应;2Cl--2e-=Cl2↑,阴极析出铜,电极反应:Cu2++2e-=Cu,观察到的现象是有红色物质析出;电解氯化铜生成氯气和铜,反应的化学方程式为:CuCl2 ![]() Cu+Cl2↑,每生成1molCu转移2mol电子。若反应过程中有0.2mol的电子发生转移,生成0.1mol铜,0.1mol氯气;则铁电极上产生铜的质量=0.1mol×64g/mol=6.4g,石墨极上产生的物质在标准状况下的体积=0.1mol×22.4L/mol=2.24L。
Cu+Cl2↑,每生成1molCu转移2mol电子。若反应过程中有0.2mol的电子发生转移,生成0.1mol铜,0.1mol氯气;则铁电极上产生铜的质量=0.1mol×64g/mol=6.4g,石墨极上产生的物质在标准状况下的体积=0.1mol×22.4L/mol=2.24L。

【题目】下列关于物质分类的正确组合是( )
分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaF2 | SO3 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. A B. B C. C D. D