题目内容
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
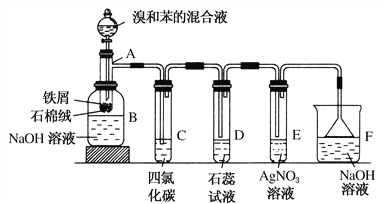
填写下列空白:
①试管A中的反应方程式为_____________________________________。
②试管C中四氯化碳的作用是:____________________________。反应开始后,观察D和E两试管,看到的现象为:________________________________。
写出E中反应的离子方程式__________________________________________。
③反应2~3 min后,在B中的NaOH溶液里可观察到的现象是___________。
④在上述整套装置中,具有防倒吸功能的仪器有________(填字母)。
【答案】 ![]() 除去HBr气体中混有的溴蒸气 D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀 Ag++Br-===AgBr↓ 在溶液底部有无色油状液体 D、E、F
除去HBr气体中混有的溴蒸气 D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀 Ag++Br-===AgBr↓ 在溶液底部有无色油状液体 D、E、F
【解析】(1)苯与液溴在铁催化下反应生成溴苯和溴化氢,反应的化学方程式为: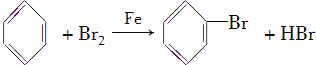 ;
;
(2)溴易挥发,易溶于有机溶剂,所以用C来吸收吸收溴化氢中的溴和挥发的有机物蒸汽,防止对溴化氢的检验造成干扰;溴化氢溶于水电离产生氢离子和氯离子,所以溶液显酸性,能使石蕊变红色,硝酸银中的银离子与溴离子反应生成淡黄色的沉淀,反应的离子方程式为:Ag++Br-=AgBr↓;
(3)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,溴化铁与氢氧化钠反应生成红褐色的氢氧化铁沉淀;
(4)装置D和E导管口在液面上方,能防止倒吸,倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,故答案为:DEF。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡。经检验该过程产生两种气体,其中一种气体有刺激性气味。

(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是_____________________
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:__________________
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:_________________
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
序号 | 实验试剂 | 实验现象 | |
实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
①上述探究实验1-2选用的盐酸为_____________(填字母)。
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响_____NH4+ 对反应影响(填“小于”、“大于”或“等于”)。
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
实验序号 | 实验试剂 | |
实验2-1 | 0.20g镁粉 | ________________ |
实验2-2 | 0.20g镁粉 | _________________ |
实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是___________________
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式_______________。





