题目内容
13.下列各组离子中,相互间不能发生复分解反应的是( )| A. | Mg2+、NH4+、SO42-、Cl- | B. | Cu2+、Na+、HCO3-、OH- | ||
| C. | K+、Ca2+、NO3-、CO32- | D. | Ag+、Fe3+、Cl-、NO3- |
分析 A.四种离子之间不满足离子反应发生条件;
B.铜离子、碳酸氢根离子、氢氧根离子之间发生复分解反应;
C.钙离子与碳酸根离子发生复分解反应;
D.银离子与氯离子发生复分解反应生成氯化银沉淀.
解答 解:A.Mg2+、NH4+、SO42-、Cl-之间不反应,满足题干要求,故A正确;
B.Cu2+、HCO3-、OH-之间发生复分解反应,不满足条件,故B错误;
C.Ca2+、CO32-之间发生复分解反应,不满足条件,故C错误;
D.Ag+、Cl-之间反应生成氯化银沉淀,该反应为复分解反应,不满足条件,故D错误;
故选A.
点评 本题考查离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握复分解反应的概念及判断方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
4.某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A. | 该温度下,此反应的平衡常数表达式是K=$\frac{{c}^{2}(X)•c(Y)}{{c}^{3}(W)}$ | |
| B. | 升高温度,若W的体积分数减小,则此反应△H>0 | |
| C. | 该温度下,再向容器中通入3 mol W,达到平衡时,n(X)=2 mol | |
| D. | 若改为体积可变容器,增大压强,正、逆反应速率均增大,平衡向正反应方向移动 |
1.化学实验必须注意安全,下列做法正确的是( )
| A. | 制取乙酸乙酯时,先将1体积的酒精倒入3体积的浓硫酸中 | |
| B. | 配置银氨溶液时,将稀氨水滴加到硝酸银溶液中至沉淀恰好溶解为止 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 制硝基苯时,直接把盛有混合液的试管在酒精灯的外焰处加热 |
18.欲用滴加试剂乙来检验溶液中是否同时含有离子X和离子Y,则下表所列四种情况下的检验能够成功的是
( )
( )
| 试剂乙 | 离子X | 离子Y | |
| A | HCl | SO42- | S2O32- |
| B | AgNO3 | Cl- | CO32- |
| C | NH4SCN | Fe2+ | Fe3+ |
| D | NH3•H2O | Al3+ | Ag+ |
| A. | A | B. | B | C. | C | D. | D |
2.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有4位同学为鉴别它们采用了以下不同的方法,其中最可行的是( )
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别配成溶液,再进行焰色反应 |
3.某无色溶液含有相同浓度的下列离子中的4种离子:K+、Na+、Al3+、Fe3+、Mg2+、Cl-、CO${\;}_{3}^{2-}$、
SO42-( )
①取少量溶液于试管中,滴加 BaCl2溶液,有白色沉淀产生,往沉淀中加盐酸,无明显现象
②用干净的铂丝蘸取少量原溶液进行焰色反应,发现火焰颜色为黄色.
SO42-( )
①取少量溶液于试管中,滴加 BaCl2溶液,有白色沉淀产生,往沉淀中加盐酸,无明显现象
②用干净的铂丝蘸取少量原溶液进行焰色反应,发现火焰颜色为黄色.
| A. | 有现象②可知有 Na+,没有 K+ | |
| B. | 不能确定溶液中有无 Al3+ | |
| C. | 溶液中一定存在 SO${\;}_{4}^{2-}$、Na+、K+ | |
| D. | 溶液中如果存在Cl-则肯定存在 Mg2+ |
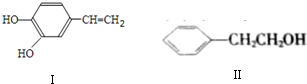
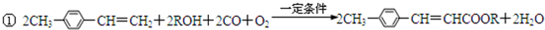
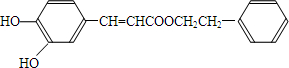 ;
;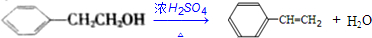 .
.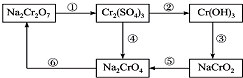 的H202,请与出该反应的离子方程式Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O
的H202,请与出该反应的离子方程式Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O