题目内容
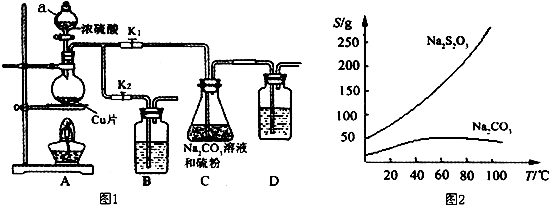
11.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2.某同学设计下列实验以确定上述混合气体中含有乙烯和SO2.(1)I、Ⅱ、Ⅲ、IV装置可盛放的试剂是:I:AⅡBⅢ:AIV:D(请将下列有关试剂的序号填入空格内).
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.溴水
(2)能说明SO2气体存在的现象是Ⅰ中品红溶液褪色;
使用装置Ⅱ的目的是除去二氧化硫以免干扰乙烯的检验;
使用装置Ⅲ的目的是检验二氧化硫是否被完全除去;
确定含有乙烯的现象是Ⅲ中的品红不褪色,Ⅳ中的高锰酸钾溶液褪色.
(3)Ⅳ中发生反应的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br;产物的名称是1,2-二溴乙烷.
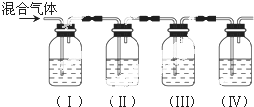
分析 (1)根据实验的目的是检验乙烯和二氧化硫,所以需要先检验乙烯中含有二氧化硫,然后除去杂质二氧化硫,再检验乙烯;
(2)根据二氧化硫能漂白品红进行检验;根据氢氧化钠溶液能与二氧化硫反应的性质分析;检验乙烯前,必须先确认乙烯中的SO2已除干净;Ⅲ中无二氧化硫,Ⅳ中与溴水反应的是乙烯;
(3)Ⅳ中乙烯与溴发生加成反应生成1,2-二溴乙烷,据此写出反应方程式.
解答 解:(1)检验二氧化硫用品红溶液,检验乙烯用溴水,乙烯和二氧化硫都能使溴水褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用溴水检验乙烯,
因装置I用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置II试管装有NaOH溶液除去SO2,装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV通过溴水褪色检验乙烯,
故答案为:A;B;A;D;
(2)装置I用来检验是否存在SO2,试管中品红溶液褪色,说明含有SO2;
氢氧化钠溶液能够与二氧化硫反应,所以装置Ⅱ试管装有NaOH溶液除去SO2;
通过装置Ⅲ试管中通过品红溶液不褪色,确认SO2已除干净;
装置Ⅳ通过溴水褪色检验乙烯,
故答案为:Ⅰ中品红溶液褪色;除去二氧化硫以免干扰乙烯的检验;检验二氧化硫是否被完全除去;Ⅲ中的品红不褪色,Ⅳ中的高锰酸钾溶液褪色;
(3)装置Ⅳ中是用溴水来检验乙烯,反应的方程式为:CH2=CH2+Br2→CH2Br-CH2Br,反应生成了1,2-二溴乙烷,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;1,2-二溴乙烷.
点评 本题考查了乙烯的实验室制法以及产物的检验,题目难度中等,注意当有多种产物需检验时,应考虑先后顺序;溴水既能氧化二氧化硫,又能与乙烯发生加成反应,检验乙烯前必须除去二氧化硫.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| B. | 达到化学平衡时,N2完全转化为NH3 | |
| C. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 | |
| D. | 单位时间内消耗amolN2同时消耗2amolNH3,说明该反应已达到平衡状态 |
( )
| A. | 2H2(g)+O2(g)═2H2O (l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+1/2O2(g)═H2O (l)△H=-285.8 kJ•mol-1 |
| A. | 向碳酸钠溶液中加入足量的盐酸 CO32-+2H+═CO2↑+H2O | |
| B. | 单质铁和三氯化铁溶液反应生成氯化亚铁 Fe+Fe3+═2Fe2+ | |
| C. | 金属钠与水反应生成氢氧化钠和氢气Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铵晶体和石灰粉共热产生氨气 NH4++OH-═NH3↑+H2O |
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 硬脂酸甘油脂的相对分子质量为890,故其属于高分子化合物 |
| A. | 明矾加入水中主要目的是悬浮杂质沉降 | |
| B. | 塑料、光导纤维、合成橡胶都属于有机高分子化合物 | |
| C. | 向含硫高的煤中加入石灰,可减少燃煤对大气的污染 | |
| D. | 利用二氧化碳等原料合成的聚二氧化碳可降解塑料有利于减少白色污染 |
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为2L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 2.4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 4.8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%;
(3)计算容器②中反应的平衡常数K=2;
(4)下列叙述正确的是ad(填字母序号);
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=$\frac{0.4}{{t}_{1}}$mol•L-1•min-1
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.