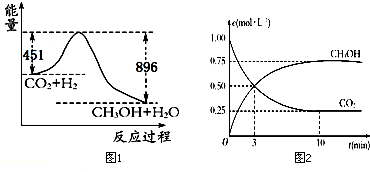
题目内容
20.化学与新型材料、环境保护、能源开发等密切相关,下列说法错误的是( )| A. | 明矾加入水中主要目的是悬浮杂质沉降 | |
| B. | 塑料、光导纤维、合成橡胶都属于有机高分子化合物 | |
| C. | 向含硫高的煤中加入石灰,可减少燃煤对大气的污染 | |
| D. | 利用二氧化碳等原料合成的聚二氧化碳可降解塑料有利于减少白色污染 |
分析 A.明矾能使水中不溶性固体小颗粒凝聚而加快沉降;
B.光导纤维不属于有机高分子化合物;
C.生石灰与煤中的硫燃烧时可生成硫酸;
D.形成白色污染的主要来源为聚乙烯材料.
解答 解:A.明矾能使水中不溶性固体小颗粒凝聚而加快沉降,为使水中的悬浮杂质沉降,可在水中加入适量的明矾,故A正确;
B.光导纤维的主要成分为二氧化硅,不属于有机高分子化合物,故B错误;
C.向高硫煤中加入生石灰,燃烧时可生成硫酸钙,可减少燃煤对大气的污染,故C正确;
D.形成白色污染的主要来源为聚乙烯材料,难以降解,但利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染,故D正确.
故选B.
点评 本题考查常见的生活环境的污染及治理,题目难度不大,注意白色污染的形成.

练习册系列答案
相关题目
10.W、X、Y、Z、M五种短周期元素在周期表中的位置如图1,ZY2是形成酸雨的主要物质之一.
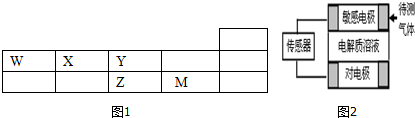
(1)M元素的离子结构示意图为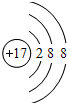
(2)Z、M二种元素的最简单气态氢化物的稳定性由强到弱的顺序为HCl>H2S(用化学式表示).
(3)NaHZ水溶液呈碱性的原因是HS-+H2?H2S+OH-((用离子方程式表示)
(4)一定条件下X2和H2在2L的密闭容器中发生如下反应X2+3H2═2XH3△H<0,测出如下数据:
反应达到平衡时,X2的转化率为33.3%,该反应的平衡常数为$\frac{1}{27}$(可用分数表示)
(5)在火箭推进器中装有强还原剂液态X2H4和强氧化剂液态H2Y2,当它们混合时,平均每转移1mol电子放热160kJ,同时生成液态水和氮气,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-640kJ/mol.
(6)传感器工作原理如右图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.若待测气体WO:电解质溶液为H2ZO4,对电极充入空气,有电流产生,则下列说法中正确的是C、D
A.敏感电极作电池正极
B.对电极上的电极反应式为:O2+2H2O+4e-=4OH-
C.敏感电极附近电解质溶液的PH变小
D.若标况下44.8mLWO通入敏感电极时,传感器上电子转移数目为0.004NA.

(1)M元素的离子结构示意图为

(2)Z、M二种元素的最简单气态氢化物的稳定性由强到弱的顺序为HCl>H2S(用化学式表示).
(3)NaHZ水溶液呈碱性的原因是HS-+H2?H2S+OH-((用离子方程式表示)
(4)一定条件下X2和H2在2L的密闭容器中发生如下反应X2+3H2═2XH3△H<0,测出如下数据:
| 时间(min) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| X2 | 3.0 | n1 | 2.4 | n3 | n5 |
| H2 | 9.0 | 8.4 | 7.2 | n4 | n6 |
| XH3 | 0 | 0.4 | n2 | 2.0 | 2.0 |
(5)在火箭推进器中装有强还原剂液态X2H4和强氧化剂液态H2Y2,当它们混合时,平均每转移1mol电子放热160kJ,同时生成液态水和氮气,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-640kJ/mol.
(6)传感器工作原理如右图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.若待测气体WO:电解质溶液为H2ZO4,对电极充入空气,有电流产生,则下列说法中正确的是C、D
A.敏感电极作电池正极
B.对电极上的电极反应式为:O2+2H2O+4e-=4OH-
C.敏感电极附近电解质溶液的PH变小
D.若标况下44.8mLWO通入敏感电极时,传感器上电子转移数目为0.004NA.
8.下列物质发生变化时,所克服的粒子间的相互作用属同种类型的是( )
| A. | 液态HF与液态HBr分别受热变为气体 | |
| B. | 氯化铵与苯分别受热变为气体 | |
| C. | 氯化钠与氯化氢分别溶解在水中 | |
| D. | 碘与干冰分别受热变为气体 |
5.NM-3是处于临床试验阶段的小分子抗癌药物,分子结构如图所示,下列说法正确的是( )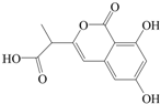

| A. | 该有机物的分子式为C12H12O6 | |
| B. | 该有机物的分子中只含有1个手性碳原子 | |
| C. | 可用FeCl3溶液检验该有机物质中是否含有苯酚 | |
| D. | 1mol该有机物最多可以和4molNaOH反应 |
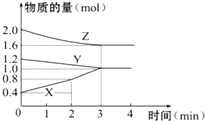 某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: