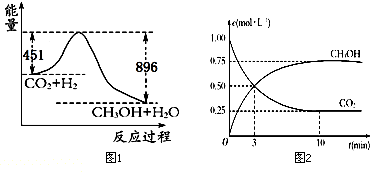
题目内容
19.硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示.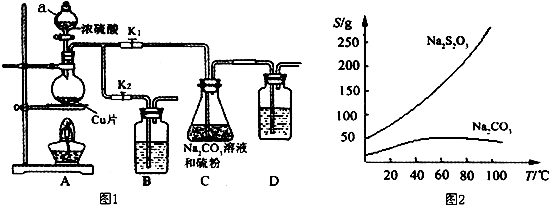
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3•5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,D中导管有气泡冒出,冷却后形成1段水柱,说明气密性良好.
步骤2:加入药品,打开K1、关闭K2,加热.装置B、D中的药品可选用下列物质中的ACD(填编号).
A.NaOH溶液 B.浓H2SO4C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl,
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O2-7;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;I2+2S2O32-═S4O62-+2I-
则该废水中Ba2+的物质的量浓度为0.0024mol/L.
分析 (1)步骤1:利用气体热胀冷缩性质,检验装置气密性;
步骤2:装置B、D的作用是进行尾气处理,防止尾气中二氧化硫污染空气;
步骤3:硫代硫酸钠在酸性溶液中不稳定,应控制溶液为弱碱性,即控制溶液pH接近或不小于7;
步骤4:从溶液中获得晶体,需要加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品;
(2)由题目信息可知,Na2S2O3被氯水氧化反应生成Na2SO4、H2SO4,氯气被还原为HCl;
(3)由题意可知,BaCrO4用盐酸溶解转化为Cr2O2-7,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,结合消耗的Na2S2O3利用关系式计算溶液中n(Ba2+),进而计算c(Ba2+).
解答 解:(1)步骤1:利用气体热胀冷缩性质,检验装置气密性,具体操作为:关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,D中导管有气泡冒出,冷却后形成1段水柱,说明气密性良好;故答案为:关闭K2打开K1,在D中加水淹没导管末端,用热毛巾或双手捂住烧瓶,D中导管有气泡冒出,冷却后形成1段水柱,说明气密性良好;
步骤2:装置B、D的作用是进行尾气处理,防止尾气中二氧化硫污染空气,二氧化硫具有还原性,可以用酸性高锰酸钾溶液氧化吸收,二氧化硫能与氢氧化钠溶液、碳酸氢钠溶液反应被吸收,故选:ACD;
步骤3:硫代硫酸钠在酸性溶液中不稳定,应控制溶液为弱碱性,可以控制溶液pH接近或不小于7,
步骤4:从溶液中获得晶体,需要加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品,
故答案为:冷却结晶;
(2)由题目信息可知,Na2S2O3被氯水氧化反应生成Na2SO4、H2SO4,氯气被还原为HCl,反应方程式为:Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl,
故答案为:Na2 S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl;
(3)由题意可知,BaCrO4用盐酸溶解转化为Cr2O2-7,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O2-7~3I2~6Na2S2O3,消耗的Na2S2O3为0.018L×0.01mol/L,则n(Ba2+)=0.018L×0.01mol/L×=0.00006mol,故溶液中c(Ba2+)==0.0024mol/L,
故答案为:0.0024mol/L.
点评 本题考查实验制备方案设计,涉及气密性检验、对实验装置及步骤的分析评价、物质的分离提纯、氧化还原反应滴定,(3)中注意利用关系式进行计算,难度中等.

| A. | 制取乙烯:乙醇与浓硫酸共热至140℃ | |
| B. | 除去甲烷中的乙炔:混合气体通过酸性高锰酸钾溶液,再经浓硫酸干燥 | |
| C. | 除去苯中的苯酚:加入NaOH溶液振荡,静置分层后,除去水层 | |
| D. | 检验氯乙烷中的氯元素:氯乙烷与NaOH的水溶液共热后,加入AgNO3溶液有白色沉淀生成证明含CI- |
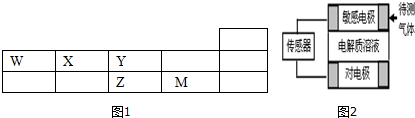
(1)M元素的离子结构示意图为

(2)Z、M二种元素的最简单气态氢化物的稳定性由强到弱的顺序为HCl>H2S(用化学式表示).
(3)NaHZ水溶液呈碱性的原因是HS-+H2?H2S+OH-((用离子方程式表示)
(4)一定条件下X2和H2在2L的密闭容器中发生如下反应X2+3H2═2XH3△H<0,测出如下数据:
| 时间(min) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| X2 | 3.0 | n1 | 2.4 | n3 | n5 |
| H2 | 9.0 | 8.4 | 7.2 | n4 | n6 |
| XH3 | 0 | 0.4 | n2 | 2.0 | 2.0 |
(5)在火箭推进器中装有强还原剂液态X2H4和强氧化剂液态H2Y2,当它们混合时,平均每转移1mol电子放热160kJ,同时生成液态水和氮气,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-640kJ/mol.
(6)传感器工作原理如右图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.若待测气体WO:电解质溶液为H2ZO4,对电极充入空气,有电流产生,则下列说法中正确的是C、D
A.敏感电极作电池正极
B.对电极上的电极反应式为:O2+2H2O+4e-=4OH-
C.敏感电极附近电解质溶液的PH变小
D.若标况下44.8mLWO通入敏感电极时,传感器上电子转移数目为0.004NA.
| A. | 萘(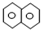 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 酚酞的结构如图所示,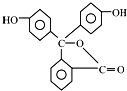 其结构中含有羟基(-OH),故酚酞属于醇 其结构中含有羟基(-OH),故酚酞属于醇 | |
| C. | 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来 | |
| D. | 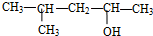 的名称为2-甲基-4-戊醇 的名称为2-甲基-4-戊醇 |
Ⅰ.测定过氧化氢的含量
步骤如下并填写下列空白:
(1)将10.00mL密度为ρ g/mL的过氧化氢溶液稀释至250mL.量取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样.此过程中需要用到的定量仪器250ml容量瓶,滴定管或移液管.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请完成该反应方程
2MnO4-+5H2O2+6H+→2Mn2++8H2O+502
(3)滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为.
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果偏高(填“偏高”“偏低”“不变”).
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性.(实验条件:试剂只有过氧化氢溶液、氯水、淀粉碘化钾溶液、二氧化锰,实验仪器及用品可自选.)
请将他们所选的实验试剂和实验现象填入下表:
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |
| 探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验 | 产生气泡,木条复燃 |
| A. | 液态HF与液态HBr分别受热变为气体 | |
| B. | 氯化铵与苯分别受热变为气体 | |
| C. | 氯化钠与氯化氢分别溶解在水中 | |
| D. | 碘与干冰分别受热变为气体 |
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物. .
. 、
、 .
.