题目内容
2.25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)═2H2O (l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+1/2O2(g)═H2O (l)△H=-285.8 kJ•mol-1 |
分析 根据2g氢气燃烧生成液态水,放出285.8kJ热量,放热时焓变值为负值来分析.
解答 解:A、因4g氢气燃烧生成液态水,放出热量571.6kJ,不是285.8kJ,故A错误;
B、因4g氢气燃烧生成液态水,放出热量571.6kJ,放热时焓变值为负值,故B错误;
C、因4g氢气燃烧生成液态水,不是气态水,放出热量571.6kJ,故C错误;
D、因2g氢气燃烧生成液态水,放出285.8kJ热量,放热时焓变值为负值,故D正确;
故选:D.
点评 本题主要考查热化学方程式的书写方法及系数的含义,注意焓变的正负和物质的状态,题目较简单.

练习册系列答案
相关题目
12.短周期元素W、X、Y和Z的原子序数依次增大.W是原子半径最小的元素,X原子的最外层电子数是内层电子数的2倍,Y元素原子的M层电子数比K层多1个,Z原子的最外层电子数是其电子层数的2倍.下列说法不正确的是( )
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与W形成的原子个数比为1:1的化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
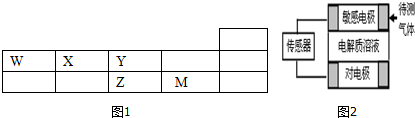
10.W、X、Y、Z、M五种短周期元素在周期表中的位置如图1,ZY2是形成酸雨的主要物质之一.
(1)M元素的离子结构示意图为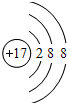
(2)Z、M二种元素的最简单气态氢化物的稳定性由强到弱的顺序为HCl>H2S(用化学式表示).
(3)NaHZ水溶液呈碱性的原因是HS-+H2?H2S+OH-((用离子方程式表示)
(4)一定条件下X2和H2在2L的密闭容器中发生如下反应X2+3H2═2XH3△H<0,测出如下数据:
反应达到平衡时,X2的转化率为33.3%,该反应的平衡常数为$\frac{1}{27}$(可用分数表示)
(5)在火箭推进器中装有强还原剂液态X2H4和强氧化剂液态H2Y2,当它们混合时,平均每转移1mol电子放热160kJ,同时生成液态水和氮气,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-640kJ/mol.
(6)传感器工作原理如右图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.若待测气体WO:电解质溶液为H2ZO4,对电极充入空气,有电流产生,则下列说法中正确的是C、D
A.敏感电极作电池正极
B.对电极上的电极反应式为:O2+2H2O+4e-=4OH-
C.敏感电极附近电解质溶液的PH变小
D.若标况下44.8mLWO通入敏感电极时,传感器上电子转移数目为0.004NA.

(1)M元素的离子结构示意图为

(2)Z、M二种元素的最简单气态氢化物的稳定性由强到弱的顺序为HCl>H2S(用化学式表示).
(3)NaHZ水溶液呈碱性的原因是HS-+H2?H2S+OH-((用离子方程式表示)
(4)一定条件下X2和H2在2L的密闭容器中发生如下反应X2+3H2═2XH3△H<0,测出如下数据:
| 时间(min) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| X2 | 3.0 | n1 | 2.4 | n3 | n5 |
| H2 | 9.0 | 8.4 | 7.2 | n4 | n6 |
| XH3 | 0 | 0.4 | n2 | 2.0 | 2.0 |
(5)在火箭推进器中装有强还原剂液态X2H4和强氧化剂液态H2Y2,当它们混合时,平均每转移1mol电子放热160kJ,同时生成液态水和氮气,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-640kJ/mol.
(6)传感器工作原理如右图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.若待测气体WO:电解质溶液为H2ZO4,对电极充入空气,有电流产生,则下列说法中正确的是C、D
A.敏感电极作电池正极
B.对电极上的电极反应式为:O2+2H2O+4e-=4OH-
C.敏感电极附近电解质溶液的PH变小
D.若标况下44.8mLWO通入敏感电极时,传感器上电子转移数目为0.004NA.
17.常温下,甲、乙、丙三位同学用实验室确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1mol/LHA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=1的HA溶液和稀盐酸个10.00mL,在加入水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是若电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是若电解质;
(1)甲的方案中,说明HA是弱电解质的理由是沉淀溶液的pH>1(填“>”、“<”或“=”).甲进行实验时的晶体存在方法是先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸取溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH;
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的定量程度的大小关系是c(填字母);
a.HA溶液中水的定量程度大b.稀盐酸中水的定量程度大c.两种溶液中水的定量程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速度快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中此时的气体的少量一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.1,该混合液中的两种浓度:c(Na+)=(填“>”、“<”或“=”)c(A)-;
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
甲:用pH试纸测定0.1mol/LHA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=1的HA溶液和稀盐酸个10.00mL,在加入水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是若电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是若电解质;
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的定量程度的大小关系是c(填字母);
a.HA溶液中水的定量程度大b.稀盐酸中水的定量程度大c.两种溶液中水的定量程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速度快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中此时的气体的少量一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.1,该混合液中的两种浓度:c(Na+)=(填“>”、“<”或“=”)c(A)-;
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
7.下列说法正确的是( )
| A. | 萘(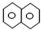 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 酚酞的结构如图所示,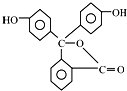 其结构中含有羟基(-OH),故酚酞属于醇 其结构中含有羟基(-OH),故酚酞属于醇 | |
| C. | 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来 | |
| D. | 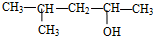 的名称为2-甲基-4-戊醇 的名称为2-甲基-4-戊醇 |
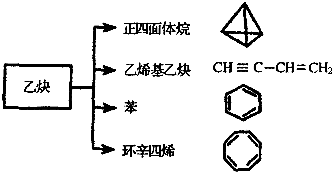 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物.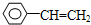 .
.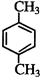 、
、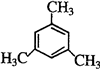 .
.