题目内容
1.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为2L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 2.4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 4.8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%;
(3)计算容器②中反应的平衡常数K=2;
(4)下列叙述正确的是ad(填字母序号);
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=$\frac{0.4}{{t}_{1}}$mol•L-1•min-1
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
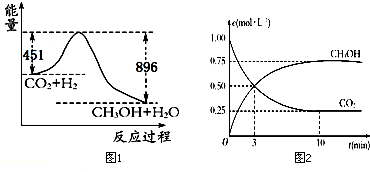
分析 (1)反应是放热反应,依据反应前后能量守恒分析判断;
(2)依据反应①热量变化结合热化学方程式计算消耗一氧化碳物质的量计算转化率;
(3)反应②和反应①在相同温度下进行,平衡常数不变,依据化学平衡三段式计算平衡浓度,结合平衡常数概念计算得到;
(4)a、反应前后气体体积不变,反应①②是相同平衡分析判断;
b、反应是可逆反应不能进行彻底;
c、反应起始浓度不同反应速率不同;
d、反应速率是单位时间内反应物浓度减小计算得到;
(5)依据热化学方程式和盖斯定律计算得到.
解答 解:(1)题干条件分析可知反应是放热反应,反应物能量高于生成物能量,反应物分子化学键断裂时所吸收的总能量小于生成物中 化学键形成所放出的热量;
故答案为:<;
(2)依据反应①热化学方程式计算;
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
起始量(mol) 1 2.4 0 0 41KJ
变化量(mol) 0.8 0.8 0.8 0.8 32.8KJ
平衡量(mol)0.2 1.6 0.8 0.8
一氧化碳平衡转化率=$\frac{0.8mol}{1mol}$×100%=80%
故答案为:80%;
(3)反应①②在相同温度下进行,平衡常数相同,依据(2)结合平衡常数概念计算=$\frac{c(CO{\;}_{2})c(H{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$=$\frac{0.8×0.8}{0.2×1.6}$=2,故答案为:2;
(4)a、反应前后气体体积不变,反应①②是相同平衡,平衡时,两容器中H2的体积分数相等,故a正确;
b、反应是可逆反应不能进行彻底,容器②中反应达平衡状态时,Q=65.6kJ,故b错误;
c、反应起始浓度不同,反应速率不同,故c错误;
d、反应速率是单位时间内反应物浓度减小计算,容器①中,反应的化学反应速率为v(H2O)=$\frac{\frac{0.8mol}{VL}}{t{\;}_{1}min}$=$\frac{0.4}{t{\;}_{1}}$mol/L•min,故d正确;
故答案为:ad;
(5)①2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
依据盖斯定律②×2+①得到:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol;
故答案为:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
点评 本题考查了化学平衡的计算应用,化学平衡的影响因素分析判断,平衡判断和平衡常数的计算是解题关键,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应,此过程中电能转化为化学能 | |
| B. | 一定条件下进行的化学反应,只能将化学能转化成光能或热能 | |
| C. | 需要加热才能进行的反应一定是吸热反应,放热反应不需要加热 | |
| D. | 将NaHCO3溶液蒸干后并加热至质量不发生变化,最终所得固体仍为NaHCO3 |
| A. | 3-甲基己烷 | B. | 4-乙基戊烷 | C. | 2-乙基戊烷 | D. | 2,2-二甲基戊烷 |
| A. | 可以制造烈性炸药TNT | B. | 可以与氢气发生加成反应 | ||
| C. | 可以与溴水发生取代反应 | D. | 可以被高锰酸钾酸性溶液氧化 |
| A. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| B. | 含有金属阳离子的晶体不一定是离子晶体 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |