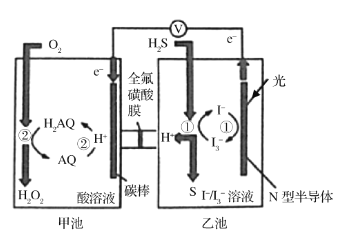
题目内容
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.增大压强使平衡向生成Z的方向移动
C.在25℃下,反应的平衡常数为1600,改变温度可以改变此反应的平衡常数
D.在25℃下,测得c(X)=0.04mol·L-1,c(Y)=0.1mol·L-1,c(Z)=0.08mol·L-1,则此时v正<v逆
【答案】D
【解析】
A.反应达到平衡时,X的转化率为![]() =50%,故A正确;
=50%,故A正确;
B.X、Y浓度减小,为反应物,Z的浓度增大,为生成物,且最终X、Y浓度不为0,说明为可逆反应,X、Y、Z化学计量数之比为(0.1-0.05)mol/L:(0.2-0.05)mol/L:0.1mol/L=1:3:2,则反应的方程式为X+3Y2Z,则增大压强,平衡向生成Z的方向移动,故B正确;
C.反应的方程式为X+3Y2Z,平衡常数K= =
=![]() =1600,平衡常数只受温度的影响,改变温度可以改变此反应的平衡常数,故C正确;
=1600,平衡常数只受温度的影响,改变温度可以改变此反应的平衡常数,故C正确;
D.在25℃下,测得c(X)=0.04mol·L-1,c(Y)=0.1mol·L-1,c(Z)=0.08mol·L-1,此时Qc= =
=![]() =160<K,则平衡正向移动,此时v正>v逆,故D错误;
=160<K,则平衡正向移动,此时v正>v逆,故D错误;
故答案为D。

【题目】下表是元素周期表的一部分。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ① | |||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ② | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素⑩的氢化物的电子式为___,此氢化物的还原性比元素⑨的氢化物__(强或弱),请用一个化学方程式证明这一事实___。
(2)分别写出⑧⑨⑩最高价氧化物对应的水化物的化学式___,并比较其酸性的强弱__
(3)能生成两性氢氧化物的元素是___,其最高价氧化物的水化物电离方程式为__。