题目内容
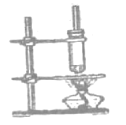
【题目】为研究金属腐蚀的条件和速率,某课外兴趣活动小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是
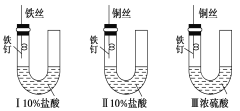
A.实验结束时,装置Ⅰ左侧的液面会下降
B.实验结束时,左侧液面装置Ⅰ比装置Ⅱ的低
C.实验结束时,装置Ⅱ中的铁钉腐蚀最严重
D.实验结束时,装置Ⅲ中的铁钉几乎没被腐蚀
【答案】B
【解析】
A.装置I中铁钉和铁丝连接,盐酸易挥发,铁钉腐蚀化学腐蚀,铁和盐酸反应生成氢气,左侧的液面一定会下降,故A正确;
B.盐酸具有挥发性,所以II中左侧空气中含有稀盐酸,导致II发生析氢腐蚀,发生了反应为2H++2e-=H2↑,生成了气体,则Ⅱ中左侧液面会下降,即左侧液面装置Ⅱ比装置Ⅰ低,故B错误;
C.装置II中盐酸易挥发,铁钉和铜丝连接易形成电化腐蚀,电化学腐蚀比化学腐蚀快,所以装置Ⅱ中的铁钉腐蚀最严重,故C正确;
D.装置III中浓硫酸是难挥发性酸,而且浓硫酸具有吸水性,则铁与硫酸不接触,即二者不发生化学反应,干燥的空气中铁不能发生电化学腐蚀,所以装置Ⅲ中的铁钉几乎没有被腐蚀,故D正确;
故答案为B。

【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
(1)CO2加氢合成低碳烯烃技术能有效利用CO2,以合成C2H4为例。该转化分为两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.3kJ/mol
CO(g)+H2O(g) ΔH1=+41.3kJ/mol
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为__。
(2)利用CO2和H2合成甲醇又是一个有效利用CO2的途径,反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①在容积为2L的恒容密闭容器中,通入2molCO2和3molH2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__(填字母)
a.消耗1.5molH2时,有0.5molCH3OH生成
b.转移3mol电子时,消耗11.2L(标准状况下)CO2
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2与生成H2O的物质的量之比为3:1
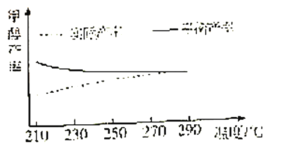
②研究温度对该反应甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速发生上述反应。得到甲醇平衡产率与温度的关系如图所示,ΔH3__0(填“>”、“=”或“<”)。判断依据是__。
③在一固定容积的密闭容器中发生上述反应。若要提高平衡时CH3OH产率,则可以采取的措施是__(填字母)。
a.升温 b.加入催化剂 c.增加CO2的浓度 d.加入H2加压 e.加入惰性气体 f.分离出甲醇
(3)在一定温度和催化剂作用下,也可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0. | a | 1.6 |
则a=__,该反应平衡常数K=__。
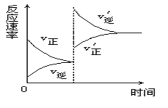
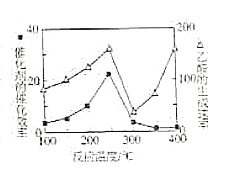
(4)以TiO2/Cu2Al2O4为催化剂,利用CH4可以将CO2直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示,乙酸的生成速率主要取决于温度影响的范围是__。250~300℃时,温度升高而乙酸的生成速率降低的原因是__。
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.增大压强使平衡向生成Z的方向移动
C.在25℃下,反应的平衡常数为1600,改变温度可以改变此反应的平衡常数
D.在25℃下,测得c(X)=0.04mol·L-1,c(Y)=0.1mol·L-1,c(Z)=0.08mol·L-1,则此时v正<v逆
【题目】在相同容积的4个密闭器中进行同一种可逆反应,2A(g)+B(g)![]() 3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:
3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:
容器 | 甲 | 乙 | 丙 | 丁 |
A | 2mol | 1mol | 2mol | 1mol |
B | 1mol | 1mol | 2mol | 2mol |
在相同温度下,建立平衡时,4个容器中A或B的转化率的大小关系是
A.A的转化率为:甲<丙<乙<丁B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:甲>丙>乙>丁D.B的转化率为:丁>乙>丙>甲