��Ŀ����
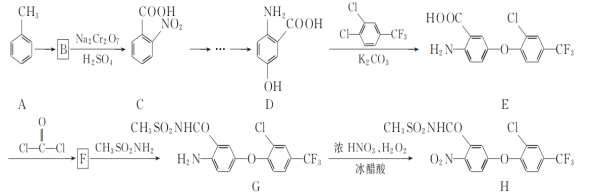
����Ŀ����ѧ���о�������ͼװ�ö���Ȼ�������������ɻ���̬ת��������̬�����ٶԻ�������Ⱦ����֪�ס��ҳ��з����ķ�Ӧ��ͼ��ʾ������˵����ȷ���ǣ� ��
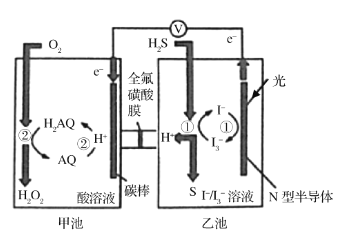
A.ȫ������ĤΪ�����ӽ���Ĥ��H+�Ӽ׳������ҳأ��ҳ���Һ��pH��С
B.��·��ÿת��2mol���ӣ��׳���Һ��������32g
C.N�Ͱ뵼��Ϊ�����������ĵ缫��ӦʽΪH2S+I3-=3I-+S��+2H+
D.�׳���̼���Ϸ����ĵ缫��ӦΪAQ+2H++2e-=H2AQ
���𰸡�D
��������
�׳��У�����������Ӧ��H2AQ+O2= H2O2+AQ��AQ+2H++2e-=H2AQ��H2AQ�Ǵ������ܷ�ӦΪ2H++O2+2e-=H2O2��OԪ�ػ��ϼ���0�����ߵ�1�ۣ�̼���������������ϵĵ缫��ӦΪAQ+2H++2e-=H2AQ���ҳ��У�N�Ͱ뵼��Ϊ�����������ĵ缫��ӦʽΪ3I--2e-= I3-���ҳص��ܷ�ӦΪH2S-2e-=2H++S����
A��ȫ������ĤΪ�����ӽ���Ĥ����ͼ��֪��H+���ҳ�����׳أ��ҳ���Ȼ������H+����������׳�Ǩ�ƣ�����ת�Ƶ���Ŀ��H+����Ŀ��ͬ�����ҳص�pH���䣬��A����
B��H+���ҳ�����׳أ��׳ص��ܷ�ӦΪ2H++O2+2e-=H2O2����·��ÿת��2mol���ӣ���Һ���ӵ���1mol���������������ҳ�ת��2mol H+��������2mol�����ӵ�����m=nM=2mol��1g/mol=2g�����Լ׳���Һ��������32g+2g=34g����B����
C��N�Ͱ뵼��Ϊ�����������ĵ缫��ӦʽΪ3I--2e-= I3-���ҳص��ܷ�ӦΪH2S-2e-=2H++S������C����
D�����ݷ�����֪���׳���̼���Ϸ����ĵ缫��ӦΪAQ+2H++2e-=H2AQ����D��ȷ��
��ѡD��

����Ŀ��CO2��һ���������壬����������滷���������Ӱ�죬ά�ִ�����CO2��ƽ�����̬��������������Ҫ���塣
��1��CO2����ϳɵ�̼ϩ����������Ч����CO2���Ժϳ�C2H4Ϊ������ת����Ϊ�������У�
��һ����CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H1=+41.3kJ/mol
CO(g)+H2O(g) ��H1=+41.3kJ/mol
�ڶ�����2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) ��H2=-210.5kJ/mol
C2H4(g)+2H2O(g) ��H2=-210.5kJ/mol
CO2����ϳ���ϩ���Ȼ�ѧ����ʽΪ__��
��2������CO2��H2�ϳɼ״�����һ����Ч����CO2��;������Ӧ���£�CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H3
CH3OH(g)+H2O(g) ��H3
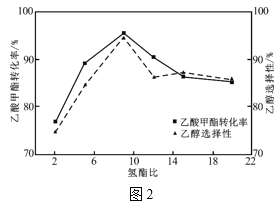
�����ݻ�Ϊ2L�ĺ����ܱ������У�ͨ��2molCO2��3molH2����������Ӧ������˵���ܹ������ÿ��淴Ӧ�ﵽƽ��״̬����__������ĸ��
a.����1.5molH2ʱ����0.5molCH3OH����
b.ת��3mol����ʱ������11.2L����״���£�CO2
c.��ϵ��������ܶȲ���
d.ˮ����������������ֲ���
e.��λʱ��������H2������H2O�����ʵ���֮��Ϊ3��1
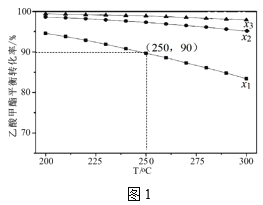
���о��¶ȶԸ÷�Ӧ�״����ʵ�Ӱ�졣��210�桫290�棬����ԭ������CO2��H2��Ͷ�ϱȲ��䣬��һ�����ٷ���������Ӧ���õ��״�ƽ��������¶ȵĹ�ϵ��ͼ��ʾ����H3__0�����������=�����������ж�������__��
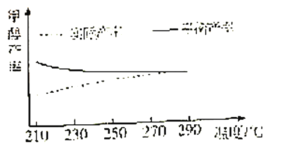
����һ�̶��ݻ����ܱ������з���������Ӧ����Ҫ���ƽ��ʱCH3OH���ʣ�����Բ�ȡ�Ĵ�ʩ��__������ĸ����
a.���� b.������� c.����CO2��Ũ�� d.����H2��ѹ e.����������� f.������״�
��3����һ���¶Ⱥʹ��������£�Ҳ�ɽ�CO2ת��Ϊȼ��CH4����Ӧ����ʽΪCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)����30��ʱ��һ������CO2��H2����������ݻ�Ϊ1L�ĺ����ܱ������з���������Ӧ��5min��ﵽ��⣬��ʱ�����ʵ�Ũ�����±���
CH4(g)+2H2O(g)����30��ʱ��һ������CO2��H2����������ݻ�Ϊ1L�ĺ����ܱ������з���������Ӧ��5min��ﵽ��⣬��ʱ�����ʵ�Ũ�����±���
���� | CO2(g) | H2(g) | CH4(g) | H2O(g) |
Ũ��/mol��L-1 | 0.2 | 0. | a | 1.6 |
��a=__���÷�Ӧƽ�ⳣ��K=__��
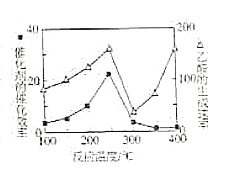
��4����TiO2/Cu2Al2O4Ϊ����������CH4���Խ�CO2ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ��ʾ�����������������Ҫȡ�����¶�Ӱ��ķ�Χ��__��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����__��
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵���������
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50��
B.����ѹǿʹƽ��������Z�ķ����ƶ�
C.��25���£���Ӧ��ƽ�ⳣ��Ϊ1600���ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
D.��25���£����c(X)=0.04mol��L-1��c(Y)=0.1mol��L-1��c(Z)=0.08mol��L-1�����ʱv��<v��