题目内容
11.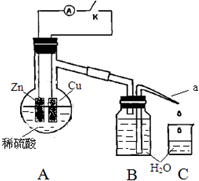 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+12O2(g)=ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+12O2(g)=H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
分析 (1)Zn与稀硫酸反应生成硫酸锌和氢气;
(2)浓硫酸具有强氧化性,与Zn反应生成二氧化硫;
(3)①Zn(s)+12O2(g)=ZnO(s)△H=-332kJ/mol
②ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
③H2(g)+12O2(g)=H2O(l)△H=-286kJ/mol
根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2↑,据此计算;
(3)①形成原电池能加快反应速率;
②根据氢离子浓度大小与速率的关系分析;
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,根据温度对速率的影响分析.
解答 解:(1)Zn与稀硫酸反应生成硫酸锌和氢气,其反应的离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(2)浓硫酸具有强氧化性,与Zn反应生成二氧化硫,所以制H2时,用稀硫酸而不用浓硫酸,故答案为:浓H2SO4具有强氧化性,不能生成氢气;
(3)①Zn(s)+12O2(g)=ZnO(s)△H=-332kJ/mol
②ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
③H2(g)+12O2(g)=H2O(l)△H=-286kJ/mol
根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2↑,则△H=(-332kJ/mol)+(-112kJ/mol)-(-286kJ/mol)=-158kJ/mol;
故答案为:-158;
(3)①形成原电池能加快反应速率,所以在反应初期,闭合K时比断开K时的反应速率快,故答案为:快;形成原电池反应速度快;
②由于反应前期形成原电池反应速率快,氢离子消耗的多,则在后期,闭合K时溶液中氢离子浓度小,氢离子浓度越小反应速率越小,断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),所以在反应后期,断开K时的反应速率快于闭合K时的反应速率;
故答案为:断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+);
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,则随着反应进行,断开K时,放出的热量使溶液的温度升高,温度越高反应速率越快;
故答案为:断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
点评 本题考查了盖斯定律的应用、原电池原理的应用、影响速率的因素等,题目难度中等,注意形成原电池能加快反应速率.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 铪-185的原子核内有72个电子 | B. | 其中子数比电子数多41 | ||
| C. | 是铪-180的一种新的同素异形体 | D. | 铪-185的原子核内有185个质子 |
| A. | 化学反应的限度都相同 | |
| B. | 化学反应的限度可以改变 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
| A. | C和Mg | B. | Si和Na | C. | Cl和C | D. | B和He |
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:12H2SO4(aq)+NaOH(aq)=12Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
| X | ||||
| R |
 ;
; 的系统命名为2,5-二甲基-3-乙基庚烷.
的系统命名为2,5-二甲基-3-乙基庚烷. 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;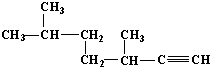 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;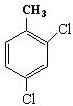 ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基.