题目内容
6.按要求书写:(1)甲基的电子式
 ;
;(2)①
 的系统命名为2,5-二甲基-3-乙基庚烷.
的系统命名为2,5-二甲基-3-乙基庚烷.②CH3CH2C(CH3)2CH2CH(C2H5)CH3的系统命名为3,3,5-三甲基庚烷.
分析 (1)甲基中含有3个碳氢键,碳原子最外层为7个电子,据此写出甲基的电子式;
(2)①该有机物为烷烃,根据烷烃的命名原则进行解答;
②该有机物为烷烃,根据烷烃的系统命名法命名.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为: ,故答案为:
,故答案为: ;
;
(2)① 该有机物为烷烃,分子中最长碳链含有7个C,主链为庚烷,编号从右下端开始,在2号、5号碳上含有1个甲基,在3号碳上含有1个乙基,该有机物命名为:2,5-二甲基-3-乙基庚烷,故答案为:2,5-二甲基-3-乙基庚烷;
该有机物为烷烃,分子中最长碳链含有7个C,主链为庚烷,编号从右下端开始,在2号、5号碳上含有1个甲基,在3号碳上含有1个乙基,该有机物命名为:2,5-二甲基-3-乙基庚烷,故答案为:2,5-二甲基-3-乙基庚烷;
②CH3CH2C(CH3)2CH2CH(C2H5)CH3该有机物为烷烃,最长碳链为7,为庚烷,在3号碳和5号碳上各含有2个甲基和1个甲基,正确命名为:3,3,5-三甲基庚烷,故答案为:3,3,5-三甲基庚烷.
点评 本题考查了电子式的书写、有机物的命名,题目难度中等,注意掌握常见有机物的命名方法,明确电子式的概念及书写原则.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列各项表达中正确的是( )
| A. | 聚丙烯的结构简式: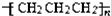 | B. | 乙醇的结构简式:CH3CH2OH | ||
| C. | 四氯化碳的电子式: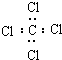 | D. | -CH3(甲基)的电子式为 |
17.下列叙述正确的是( )
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
14. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
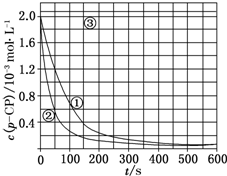
【数据处理】实验测得p-CP的浓度随时间变化的关系如图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可).
11. 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.
(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
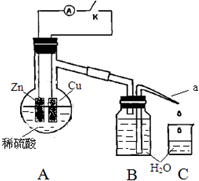
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
18.下列关于晶体的说法正确的是( )
| A. | 晶体中只要有阳离子就一定有阴离子 | |
| B. | 氢键属于分子间作用力,不存在于分子内 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 构成分子晶体的微粒不一定含有共价键 |
16.油酸的结构简式为CH3(CH2)7CH=CH(CH2)7COOH,下列说法正确的是( )
| A. | 油酸的分子式为C18H33O2 | B. | 油酸是乙酸的同系物 | ||
| C. | 油酸可与氢气发生加成反应 | D. | 1 mol甘油最多可与1 mol油酸酯化 |
 .
.
 ,该化合物由离子键形成.
,该化合物由离子键形成. ,
, .
.