题目内容
5.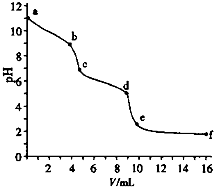 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )| A. | a处发生的离子反应:CO32-+H2O=HCO3-+OH- | |
| B. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应:CO32-+H+=HCO3- |
分析 A、根据滴定之前溶液的pH,盐酸的体积是零,碳酸钠溶液水解显示碱性来判断;
B、在pH=6时,溶液显酸性,根据溶液的组成情况确定离子浓度的大小关系;
C、根据电荷守恒以及溶液显示中性时氢离子和氢氧根离子浓度相等来判断;
D、根据pH变化图象结合滴定实际来回答.
解答 解:A、滴定之前碳酸钠溶液的pH=11,所以溶液中氢氧根离子的浓度为0.001 mol•L-1,该Na2CO3溶液中碳酸根离子水解导致溶液显示碱性,发生反应为:CO32-+H2O?HCO3-+OH-,水解程度很弱,应该使用可逆号,故A错误;
B、在pH=6时,溶液显酸性,溶液的组成可能是:碳酸氢钠和饱和二氧化碳溶液的混合物,此时c(Na+)>c(HCO3-)>c(CO32-),故B正确;
C、在pH=7时,溶液显示中性,氢离子和氢氧根离子浓度相等,此时溶液中还含有碳酸根离子和碳酸氢根离子,所以钠离子大于氯离子浓度,故C错误;
D、根据pH变化曲线,可以看出c到d阶段,随着盐酸的加入,碳酸氢根与氢离子反应,故D错误.
故选B.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分是解题的关键.

练习册系列答案
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
2.SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx,分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O,
下列说法正确的是( )
下列说法正确的是( )
| A. | NO2为酸性氧化物 | |
| B. | H2O很稳定是因为水分子之间存在氢键 | |
| C. | 反应③中每生成22.4 LN2,转移电子数1.5NA | |
| D. | NH3的沸点比PH3的沸点高 |
16.锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与钙和钡属于第ⅡA族元素.
(1)碱性;Sr(OH)2<Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的 观点解释其原因是同一主族元素,原子最外层电子数相同.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3.
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
①步骤Ⅰ中,反应的化学方程式是SrSO4+Na2CO3=SrCO3+Na2SO4.为提高此步骤中锶的转化效果可以采取的措施有(任答两点即可):增加碳酸钠溶液,搅拌.
②步骤Ⅱ中,能与盐酸反应而溶解的物质有SrCO3、BaCO3、FeO、Fe2O3、Al2O3.
③步骤Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全.
④下列关于该工艺流程的说法正确的是ac(填字母代号).
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率.
(1)碱性;Sr(OH)2<Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的 观点解释其原因是同一主族元素,原子最外层电子数相同.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3.
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 4.7 |
②步骤Ⅱ中,能与盐酸反应而溶解的物质有SrCO3、BaCO3、FeO、Fe2O3、Al2O3.
③步骤Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全.
④下列关于该工艺流程的说法正确的是ac(填字母代号).
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率.
13.某古墓出土的重要文物有字画、玉带、银钵、铁猪及铁牛等.其中金属制品中保存较好的可能是( )
| A. | 银钵 | B. | 玉带 | C. | 字画 | D. | 铁牛 |
20.某主族元素的最高价氧化物的水化物的化学式是HRO3,则该元素的气态氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH4 | D. | RH3 |
10.盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是( )
| A. | 10mL0.10mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) | |
| C. | 在NaHCO3溶液中加入等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH的物质的量相同 |
17.下列实验现象和所列出的相应结论均正确的是( )
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | 常温下白磷可自燃而N2须在放电时才与O2反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关化学用语使用不正确的是( )
| A. | 氯原子的原子结构示意图: | |
| B. | C2H4的结构简式:CH2CH2 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | CH4 分子的结构模型: |
15.下列反应用于工业生产的是( )
| A. | 氯气与石灰乳反应制漂白粉 | B. | 钠在氯气中燃烧生成氯化钠 | ||
| C. | 氯化铵与氢氧化钙共热制氨气 | D. | 浓盐酸与二氧化锰共热制氯气 |